
Absorção o que é, exemplos e exercícios resolvidos
O absorbância é o logaritmo com um sinal negativo do quociente entre a intensidade da luz emergente e a intensidade da luz incidente em uma amostra de solução translúcida que foi iluminada com luz monocromática. Este quociente é o transmitância.
O processo físico de passagem da luz através de uma amostra é denominado transmissão de luz, e a absorbância é uma medida disso. Assim, a absorbância se torna o menor logaritmo da transmitância e é um dado importante para determinar a concentração de uma amostra que geralmente está dissolvida em um solvente como água, álcool ou qualquer outro..
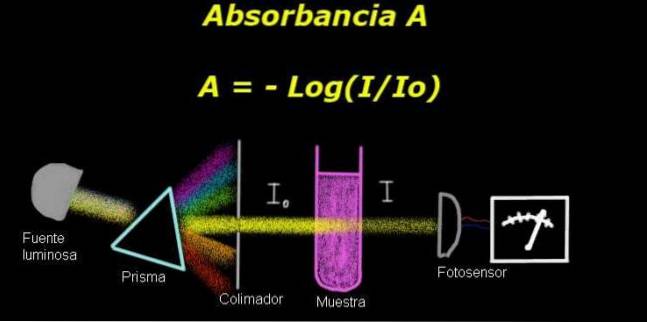
Para medir a absorbância, você precisa de um dispositivo chamado eletrofotômetro, com a qual uma corrente que é proporcional à intensidade da luz incidente em sua superfície é medida.
Ao calcular a transmitância, geralmente o sinal de intensidade correspondente ao solvente sozinho é medido primeiro e este resultado é registrado como Io.
Em seguida, a amostra dissolvida é colocada no solvente sob as mesmas condições de iluminação. O sinal medido pelo eletrofotômetro é denotado como eu, que permite calcular a transmitância T de acordo com a seguinte fórmula:
T = I / Iou
É uma quantidade adimensional. O absorbância A é assim expresso como:
A = - log (T) = - log (I / Iou)
Índice do artigo
- Absorvância e absortividade de 1 molar
- 1.1 Lei de Beer-Lambert
- 2 exemplos
- 2.1 Exemplo 1
- 2.2 Exemplo 2
- 3 exercícios resolvidos
- 3.1 Exercício 1
- 3.2 Exercício 2
- 3.3 Exercício 3
- 4 referências
Absorvância e absortividade molar
As moléculas que compõem uma substância química são capazes de absorver luz, e uma medida disso é precisamente a absorvância. É o resultado da interação entre fótons e elétrons moleculares.
Portanto, é uma magnitude que vai depender da densidade ou concentração das moléculas que compõem a amostra e também do caminho óptico ou da distância percorrida pela luz..
Os dados experimentais indicam que a absorbância PARA é linearmente proporcional à concentração C e à distância d atravessado pela luz. Portanto, para calculá-lo com base nesses parâmetros, a seguinte fórmula pode ser estabelecida:
A = ε⋅C⋅d
Na fórmula acima, ε é uma constante de proporcionalidade conhecida como absortividade molar.
A absortividade molar depende do tipo de substância e do comprimento de onda no qual a absorbância é medida. O absortividade molar também é sensível à temperatura da amostra e ao pH da amostra.
Lei Beer-Lambert
Essa relação entre absorbância, absortividade, concentração e distância da espessura do caminho que a luz segue dentro da amostra é conhecida como lei de Beer-Lambert..

Aqui estão alguns exemplos de como usá-lo.
Exemplos
Exemplo 1
Durante um experimento, uma amostra é iluminada com luz vermelha de um laser de hélio-neon, cujo comprimento de onda é de 633 nm. Um eletrofotômetro mede 30 mV quando a luz do laser atinge diretamente e 10 mV quando passa por uma amostra..
Neste caso, a transmitância é:
T = I / Io = 10 mV / 30 mV = ⅓.
E a absorbância é:
A = - log (⅓) = log (3) = 0,48
Exemplo 2
Se a mesma substância for colocada em um recipiente com metade da espessura do usado no Exemplo 1, indique o quanto o eletrofotômetro marcará, quando a luz do laser de hélio-neon passar pela amostra.
Deve-se considerar que se a espessura diminui pela metade, então a absorbância que é proporcional à espessura óptica diminui pela metade, ou seja, A = 0,28. A transmitância T será dada pela seguinte relação:
T = 10-A = 10 ^ (- 0,28) = 0,53
O eletrofotômetro irá ler 0,53 * 30 mV = 15,74 mV.
Exercícios resolvidos
Exercício 1
Queremos determinar a absortividade molar de um determinado composto patenteado que está em solução. Para fazer isso, a solução é iluminada com luz de uma lâmpada de sódio de 589 nm. A amostra será colocada em um porta-amostras de 1,50 cm de espessura.
O ponto de partida é uma solução com uma concentração de 4,00 × 10 ^ -4 moles por litro e a transmitância é medida, resultando em 0,06. Usando esses dados, determine a absortividade molar da amostra..
Solução
Primeiro, a absorbância é determinada, que é definida como o logaritmo mínimo para basear dez da transmitância:
A = - log (T)
A = - log (0,06) = 1,22
Em seguida, é usada a lei de Lambert-Beer que estabelece uma relação entre absorbância, absortividade molar, concentração e comprimento óptico:
A = ε⋅C⋅d
Resolvendo a absortividade molar, a seguinte relação é obtida:
ε = A / (C⋅d)
substituindo os valores dados, temos:
ε = 1,22 / (4,00 × 10 ^ -4 M⋅1,5 cm) = 2030 (M⋅cm) ^ - 1
O resultado acima foi arredondado para três dígitos significativos.
Exercício 2
Para melhorar a precisão e determinar o erro da medição da absortividade molar da amostra no exercício 1, a amostra é sucessivamente diluída até a metade da concentração e a transmitância é medida em cada caso..
A partir de Co = 4 × 10 ^ -4 M com transmitância T = 0,06, a seguinte sequência de dados é obtida para transmitância e absorbância calculada a partir da transmitância:
Co / 1-> 0,06-> 1,22
Co / 2-> 0,25-> 0,60
Co / 4-> 0,50-> 0,30
Co / 8-> 0,71-> 0,15
Co / 16-> 0,83-> 0,08
Co / 32-> 0,93-> 0,03
Co / 64-> 0,95-> 0,02
Co / 128-> 0,98-> 0,01
Co / 256-> 0,99-> 0,00
Com esses dados, execute:
a) Um gráfico de absorbância versus concentração.
b) Um ajuste linear dos dados e encontre a inclinação.
c) A partir da inclinação obtida, calcule a absortividade molar.
Solução
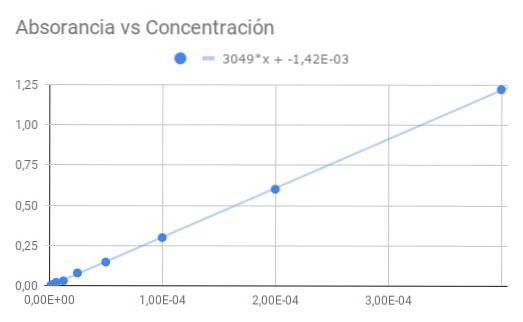
A inclinação obtida é o produto da absortividade molar pela distância óptica, dividindo a inclinação pelo comprimento 1,5 cm obtemos a absortividade molar
ε = 3049 / 1,50 = 2033 (M⋅cm) ^ - 1
Exercício 3
Com os dados do exercício 2:
a) Calcule a absortividade para cada dado.
b) Determine um valor médio para a absortividade molar, seu desvio padrão e o erro estatístico associado à média..
Solução
A absortividade molar é calculada para cada uma das concentrações testadas. Lembre-se de que as condições de iluminação e a distância óptica permanecem fixas.
Os resultados para a absortividade molar são:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 em unidades de 1 / (M * cm).
A partir desses resultados, podemos obter o valor médio:
<ε> = 1998 (M * cm) ^ - 1
Com um desvio padrão de: 184 (M * cm) ^ - 1
O erro médio é o desvio padrão dividido pela raiz quadrada do número de dados, ou seja:
Δ<ε>= 184/9 ^ 0,5 = 60 (M * cm) ^ - 1
Finalmente, conclui-se que a substância patenteada tem uma absortividade molar na frequência 589 nm produzida por uma lâmpada de sódio de:
<ε> = (2000 ± 60) (M * cm) ^ - 1
Referências
- Atkins, P. 1999. Physical Chemistry. Edições Omega. 460-462.
- A guia. Transmitância e absorbância. Recuperado de: quimica.laguia2000.com
- Toxicologia Ambiental. Transmitância, absorbância e lei de Lambert. Recuperado de: repositorio.innovacionumh.es
- Aventura física. Absorbância e transmitância. Recuperado de: rpfisica.blogspot.com
- Espectofotometria. Recuperado de: chem.libretexts.org
- Toxicologia Ambiental. Transmitância, absorbância e lei de Lambert. Recuperado de: repositorio.innovacionumh.es
- Wikipedia. Absorvância Recuperado de: wikipedia.com
- Wikipedia. Espectrofotometria. Recuperado de: wikipedia.com



Ainda sem comentários