
Estrutura, propriedades, síntese da acetanilida (C8H9NO)
O acetanilida (C8H9NO) é uma amida aromática que recebe vários nomes adicionais: N-acetilarilamina, N-fenilacetamida e acetanil. Apresenta-se como um sólido inodoro na forma de flocos, sua natureza química é amida, e como tal pode formar gases inflamáveis ao reagir com agentes redutores fortes..
Além disso, é uma base fraca, podendo reagir com agentes desidratantes como o PdoisOU5 para dar origem a um nitrilo. Descobriu-se que a acetanilida tinha ação analgésica e antipirética e foi usada em 1886 com o nome de Antifebrina por A. Cahn e P. Hepp..

Em 1899, foi introduzido no mercado o ácido acetilsalicílico (aspirina), que tinha as mesmas ações terapêuticas da acetanilida. Como o uso de acetanilida estava relacionado ao aparecimento de cianose nos pacientes - consequência da metemoglobinemia induzida pela acetanilida - seu uso foi descartado..
Posteriormente, foi estabelecido que a ação analgésica e antipirética da acetanilida residia em um metabólito desta denominado paracetamol (acetoaminofeno), que não teve seus efeitos tóxicos, conforme sugerido por Axelrod e Brodie..
Índice do artigo
- 1 Estrutura química
- 1.1 Estruturas de ressonância e interações intermoleculares
- 2 propriedades químicas
- 2.1 Peso molecular
- 2.2 Descrição química
- 2.3 Odor
- 2.4 Sabor
- 2,5 ponto de ebulição
- 2.6 Ponto de fusão
- 2.7 Ponto de fulgor ou ponto de fulgor
- 2.8 Densidade
- 2,9 Densidade de vapor
- 2.10 Pressão de vapor
- 2.11 Estabilidade
- 2.12 Volatilidade
- 2.13 Autoignição
- 2.14 Decomposição
- 2,15 pH
- 2,16 Solubilidade
- 3 Síntese
- 4 aplicativos
- 5 referências
Estrutura química
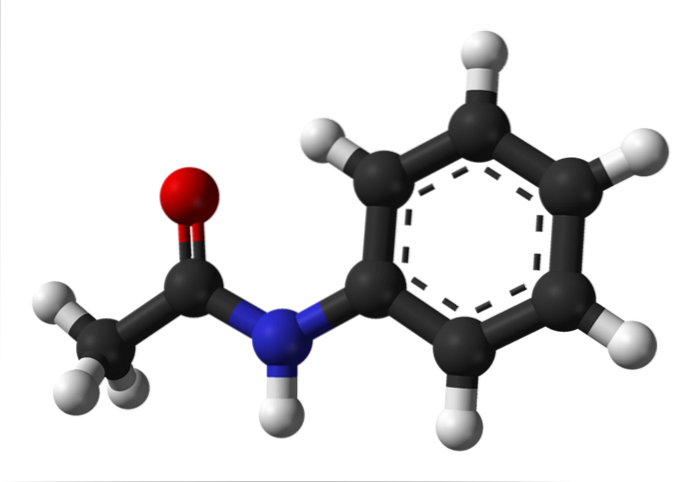
A imagem superior representa a estrutura química da acetanilida. À direita está o anel aromático hexagonal de benzeno (com linhas pontilhadas), e à esquerda está o motivo pelo qual o composto consiste em uma amida aromática: o grupo acetamido (HNCOCH3).
O grupo acetamido dá ao anel benzeno um caráter polar maior; ou seja, ele cria um momento de dipolo na molécula de acetanilida.
Por quê? Porque o nitrogênio é mais eletronegativo do que qualquer um dos átomos de carbono no anel e também está ligado ao grupo acila, cujo átomo O também atrai densidade de elétrons.
Por outro lado, quase toda a estrutura molecular da acetanilida repousa no mesmo plano devido à hibridização spdois dos átomos que o compõem.
Há uma exceção ligada àquelas do grupo -CH3, cujos átomos de hidrogênio constituem os vértices de um tetraedro (as esferas brancas na extremidade esquerda saem do plano).
Estruturas de ressonância e interações intermoleculares
O par solitário sem compartilhar no átomo N circula pelo sistema π do anel aromático, originando diversas estruturas de ressonância. Porém, uma dessas estruturas acaba com carga negativa no átomo O (mais eletronegativa) e carga positiva no átomo N..
Assim, existem estruturas de ressonância onde uma carga negativa se move no anel, e outra onde reside no átomo de O. Como consequência dessa "assimetria eletrônica" - que vem de mãos dadas com a assimetria molecular -, a acetanilida interage intermolecularmente por dipolo -forças de dipolo.
No entanto, as interações de ligações de hidrogênio (N-H-O- ...) entre duas moléculas de acetanilida são, de fato, a força predominante em sua estrutura cristalina..
Assim, os cristais de acetanilida consistem em células unitárias ortorrômbicas de oito moléculas orientadas em formas de “fita plana” por suas ligações de hidrogênio..
Isso pode ser visualizado colocando uma molécula de acetanilida em cima da outra, em paralelo. Então, como os grupos HNCOCH3 se sobrepõem espacialmente, eles formam ligações de hidrogênio.
Além disso, entre essas duas moléculas uma terceira também pode "deslizar", mas com seu anel aromático apontando para o lado oposto..
Propriedades quimicas
Peso molecular
135,166 g / mol.
Descrição química
Branco sólido ou esbranquiçado. Forma flocos brancos brilhantes ou um pó cristalino branco.
Odor
Banheiro.
Gosto
Ligeiramente picante.
Ponto de ebulição
304 ° C a 760 mmHg (579 ° F a 760 mmHg).
Ponto de fusão
114,3 ° C (237,7 ° F).
Ponto de fulgor ou ponto de fulgor
169 ° C (337 ° F). Medição feita em vidro aberto.
Densidade
1.219 mg / mL a 15ºC (1.219 mg / mL a 59ºF)
Densidade do vapor
4,65 em relação ao ar.
Pressão de vapor
1 mmHg a 237ºF, 1,22 × 10-3 mmHg a 25ºC, 2Pa a 20ºC.
Estabilidade
Ele sofre um rearranjo químico quando exposto à luz ultravioleta. Como a estrutura muda? O grupo acetil forma novas ligações no anel nas posições orto e para. Além disso, é estável ao ar e incompatível com agentes oxidantes fortes, cáusticos e álcalis..
Volatilidade
Apreciavelmente volátil a 95 ºC.
Autoignição
1004ºF.
Decomposição
Ele se decompõe quando aquecido, emitindo uma fumaça altamente tóxica.
pH
5 - 7 (10 g / L de HdoisOu a 25 ºC)
Solubilidade
- Em água: 6,93 × 103 mg / mL a 25 ºC.
- Solubilidade de 1 g de acetanilida em diferentes líquidos: em 3,4 ml de álcool, 20 ml de água fervente, 3 ml de metanol, 4 ml de acetona, 0,6 ml de álcool fervente, 3,7 ml de clorofórmio, 5 ml de gliecerol, 8 ml de dioxano, 47 ml de benzeno e 18 ml de éter. O hidrato de cloral aumenta a solubilidade da acetanilida em água.
Síntese
É sintetizado pela reação do anidrido acético com a acetanilida. Esta reação aparece em muitos textos de Organic Chemistry (Vogel, 1959):
C6H5NHdois + (CH3CO)doisO => C6H5NHCOCH3 + CH3COOH
Formulários
-É um agente inibidor do processo de decomposição do peróxido de hidrogênio (peróxido de hidrogênio).
-Estabiliza vernizes de éster de celulose.
-Ele intervém como intermediário na aceleração da produção de borracha. Da mesma forma, é um intermediário na síntese de alguns corantes e cânfora..
-Atua como precursor na síntese da penicilina.
-É usado na produção de cloreto de 4-acetamidosulfonilbenzeno. A acetanilida reage com ácido clorossulfônico (HSO3Cl), produzindo assim cloreto de 4-aminossulfonilbenzeno. Este reage com a amônia ou uma amina orgânica primária para formar sulfonamidas..
-Foi usado experimentalmente no século 19 no desenvolvimento da fotografia.
-A acetanilida é usada como marcador de fluxos eletroosmóticos (EOF) em eletroforese capilar para o estudo da ligação entre drogas e proteínas..
-Recentemente (2016) a acetanilida foi associada a 1- (ω-fenoxialquiluracil) em experimentos para inibir a replicação do vírus da hepatite C. A acetanilida se liga à posição 3 do anel de pirimidina.
-Os resultados experimentais indicam uma redução na replicação do genoma viral, independentemente do genótipo viral..
-Antes de ser identificada a toxicidade da acetanilida, ela foi utilizada como analgésico e antipirético a partir de 1886. Posteriormente (1891), foi utilizada no tratamento da bronquite crônica e aguda por Grün.
Referências
- J. Brown e D. E. C. Corbridge. (1948). Estrutura cristalina da acetanilida: uso de radiação infravermelha polarizada. Nature volume 162, página 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) O uso de acetanilida no tratamento da bronquite aguda e crônica. Lancet 137 (3539): 1424-1426.
- Magri, A. et al. (2016). Exploração de derivados de acetanilida de 1- (ω-fenoxialquil) uracilos como novos inibidores da replicação do vírus da hepatite C. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilida. Obtido em 5 de junho de 2018, em: sigmaaldrich.com
- Relatório de Avaliação Inicial do SIDS para o 13º SIAM. Acetanilida. [PDF]. Obtido em 5 de junho de 2018, em: inchem.org
- Wikipedia. (2018). Acetanilida. Obtido em 05 de junho de 2018, em: en.wikipedia.org
- PubChem. (2018). Acetanilida. Obtido em 5 de junho de 2018, em: pubchem.ncbi.nlm.nih.gov


Ainda sem comentários