
Estrutura, propriedades, síntese e usos do acetato de etila
O acetato de etila ou etanoato de etila (Nome IUPAC) é um composto orgânico cuja fórmula química é CH3COOCdoisH5. É composto por um éster, onde o componente alcoólico deriva do etanol, enquanto o componente ácido carboxílico é proveniente do ácido acético..
É um líquido em condições normais de temperatura e pressão, apresentando um agradável aroma frutado. Esta propriedade está em perfeita harmonia com o que se espera de um éster; que é de fato a natureza química do acetato de etila. Por isso encontra uso em produtos alimentícios e bebidas alcoólicas..

A imagem superior mostra a estrutura do esqueleto do acetato de etila. Observe à esquerda seu componente ácido carboxílico e à direita o componente alcoólico. Do ponto de vista estrutural, pode-se esperar que esse composto se comporte como um híbrido entre vinagre e álcool; no entanto, ele exibe suas próprias propriedades.
É aqui que esses híbridos chamados de ésteres se destacam por serem diferentes. O acetato de etila não pode reagir como um ácido, nem pode ser desidratado devido à ausência de um grupo OH. Em vez disso, ele sofre hidrólise básica na presença de uma base forte, como hidróxido de sódio, NaOH.
Esta reação de hidrólise é usada em laboratórios de ensino para experimentos cinéticos químicos; onde a reação também é de segunda ordem. Quando ocorre a hidrólise, o etanoato de etila praticamente retorna aos seus componentes iniciais: ácido (desprotonado pelo NaOH) e álcool.
Em seu esqueleto estrutural observa-se que os átomos de hidrogênio predominam sobre os átomos de oxigênio. Isso influencia sua capacidade de interagir com espécies que não são tão polares quanto as gorduras. Da mesma forma, é utilizado para dissolver compostos como resinas, corantes e, em geral, sólidos orgânicos..
Apesar de ter um aroma agradável, a exposição prolongada a esse líquido tem impacto negativo (como quase todos os compostos químicos) no corpo..
Índice do artigo
- 1 Estrutura do acetato de etila
- 1.1 Ausência de átomos doadores de ligação de hidrogênio
- 2 Propriedades físicas e químicas
- 2.1 Nomes
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Descrição física
- 2,5 cores
- 2.6 Odor
- 2.7 Sabor
- 2.8 Limite de odor
- 2.9 Ponto de ebulição
- 2.10 Ponto de fusão
- 2.11 Solubilidade em água
- 2.12 Solubilidade em solventes orgânicos
- 2.13 Densidade
- 2,14 Densidade de vapor
- 2,15 Estabilidade
- 2.16 Pressão de vapor
- 2,17 Viscosidade
- 2,18 Calor de combustão
- 2.19 Calor de vaporização
- 2.20 Tensão superficial
- 2.21 Índice de refração
- 2.22 Temperatura de armazenamento
- 2,23 pKa
- 3 Síntese
- 3.1 Reação de Fisher
- 3.2 Reação de Tishchenko
- 3.3 Outros métodos
- 4 usos
- 4.1 Solvente
- 4.2 Sabores artificiais
- 4.3 Analytics
- 4.4 Sínteses Orgânicas
- 4.5 Cromatografia
- 4.6 Entomologia
- 5 riscos
- 6 referências
Estrutura do acetato de etila
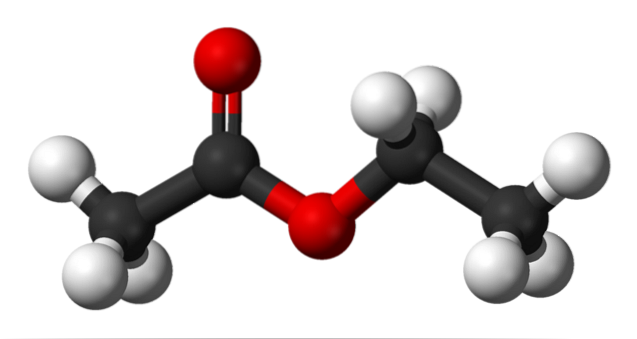
A imagem superior mostra a estrutura do acetato de etila com um modelo de esferas e barras. Neste modelo, os átomos de oxigênio são destacados com esferas vermelhas; à sua esquerda está a fração derivada do ácido, e à sua direita a fração derivada do álcool (grupo alcóxi, -OR).
O grupo carbonil é visto pela ligação C = O (as barras duplas). A estrutura em torno deste grupo e do oxigênio adjacente é plana, devido ao fato de haver uma deslocalização da carga por ressonância entre os dois oxigênios; um fato que explica uma acidez relativamente baixa dos hidrogênios α (aqueles do grupo -CH3, ligado a C = O).
Ao girar duas de suas ligações, a molécula favorece diretamente como ela interage com outras moléculas. A presença dos dois átomos de oxigênio e a assimetria na estrutura conferem-lhe um momento de dipolo permanente; que por sua vez é responsável por suas interações dipolo-dipolo.
Por exemplo, a densidade do elétron é maior perto dos dois átomos de oxigênio, diminuindo consideravelmente no grupo -CH.3, e gradualmente no grupo OCHdoisCH3.
Devido a essas interações, as moléculas de acetato de etila formam um líquido em condições normais, que possui um ponto de ebulição consideravelmente alto (77ºC)..
Ausência de átomos doadores de ligação de hidrogênio
Se você olhar atentamente para a estrutura, notará a ausência de um átomo capaz de doar uma ligação de hidrogênio. No entanto, os átomos de oxigênio são esses aceitadores e, por causa do acetato de etila, é muito solúvel em água e interage em um grau estimável com compostos polares e doadores de ligações de hidrogênio (como açúcares)..
Além disso, isso permite que ele interaja perfeitamente com o etanol; razão pela qual sua presença não é perdida em bebidas alcoólicas.
Por outro lado, seu grupo alcóxi o torna capaz de interagir com certos compostos apolares, como clorofórmio, CH3Cl.
Propriedades físicas e químicas
Nomes
-Acetato de etila
-Etanoato de etila
-Éster etil acético
-Acetoxietano
Fórmula molecular
C4H8OUdois ou CH3COOCdoisH5
Peso molecular
88,106 g / mol.
Descrição física
Líquido límpido incolor.
Cor
Líquido incolor.
Odor
Característico dos éteres, semelhante ao cheiro do abacaxi.
Gosto
Agradável quando diluído, adiciona um sabor frutado à cerveja.
Limiar de odor
3,9 ppm. 0,0196 mg / m3 (baixo odor); 665 mg / m3 (odor alto).
Odor detectável em 7 - 50 ppm (média = 8 ppm).
Ponto de ebulição
171ºF a 760mmHg (77,1ºC).
Ponto de fusão
-118,5ºF (-83,8ºC).
Solubilidade em água
80 g / L.
Solubilidade em solventes orgânicos
Miscível com etanol e éter etílico. Muito solúvel em acetona e benzeno. Também miscível com clorofórmio, óleos fixos e voláteis, e também com solventes oxigenados e clorados.
Densidade
0,9003 g / cm3.
Densidade do vapor
3,04 (no ar: proporção 1).
Estabilidade
Ele se decompõe lentamente com a umidade; incompatível com vários plásticos e agentes oxidantes fortes. Misturar com água pode ser explosivo.
Pressão de vapor
93,2 mmHg a 25 ºC
Viscosidade
0,423 mPoise a 25 ºC.
Calor de combustão
2.238,1 kJ / mol.
Calor da vaporização
35,60 kJ / mol a 25 ºC.
Tensão superficial
24 dinas / cm a 20 ° C.
Índice de refração
1.373 a 20 ºC / D.
Temperatura de armazenamento
2 - 8 ºC.
pKa
16 - 18 a 25 ºC.
Síntese
Reação de Fisher
O acetato de etila é sintetizado industrialmente pela reação de Fisher, na qual o etanol é esterificado com ácido acético. A reação é realizada à temperatura ambiente.
CH3CHdoisOH + CH3COOH <=> CH3COOCHdoisCH3 + HdoisOU
A reação é acelerada por catálise ácida. O equilíbrio se desloca para a direita, ou seja, em direção à produção de acetato de etila, por meio da remoção da água; de acordo com a Lei de Ação em Massa.
Reação de Tishchenko
O acetato de etila também é preparado industrialmente usando a reação de Tishchenko, conjugando dois equivalentes de acetaldeído com o uso de um alcóxido como catalisador..
2 CH3CHO => CH3COOCHdoisCH3
Outros métodos
-O acetato de etila é sintetizado como um coproduto na oxidação do butano a ácido acético, em uma reação realizada a uma temperatura de 175ºC e 50 atm de pressão. É usado como um catalisador para íons cobalto e cromo.
-O acetato de etila é um subproduto da etanólise do acetato de polivinila em álcool polivinílico.
-O acetato de etila também é produzido na indústria por meio da desidrogenação do etanol, catalisando a reação pelo uso do cobre em alta temperatura, porém inferior a 250 ºC..
Formulários
Solvente
O acetato de etila é utilizado como solvente e diluente, sendo utilizado na limpeza de placas de circuito. É usado como solvente na fabricação de extrato de lúpulo modificado e na descafeinação de folhas de café e chá. É usado nas tintas usadas para marcar frutas e vegetais.
O acetato de etila é utilizado na indústria têxtil como agente de limpeza. É utilizado na calibração de termômetros, utilizados na separação de açúcares. Na indústria de tintas é utilizado como solvente e diluente dos materiais utilizados..
Sabores artificiais
É utilizado na produção de aromas de frutas; por exemplo: banana, pêra, pêssego e abacaxi, bem como aroma de uva, etc..
Analytics
É utilizado na determinação de bismuto, boro, ouro, molibdênio e platina, além de solvente para tálio. O acetato de etila tem a capacidade de extrair muitos compostos e elementos presentes na solução aquosa, tais como: fósforo, cobalto, tungstênio e arsênio.
Sínteses orgânicas
O acetato de etila é usado na indústria como um redutor de viscosidade para resinas usadas em formulações fotorresistentes. Usado na produção de acetamida, acetato de acetila e metil heptanona.
Cromatografia
O acetato de etila é usado em laboratórios como fase móvel de cromatografia em coluna e como solvente de extração. Como o acetato de etila tem um ponto de ebulição relativamente baixo, é fácil de evaporar, permitindo que as substâncias dissolvidas no solvente sejam concentradas.
Entomologia
O acetato de etila é utilizado em entomologia para sufocar insetos colocados em um recipiente, permitindo sua coleta e estudo. Os vapores de acetato de etila matam o inseto sem destruí-lo e evitando que ele endureça, facilitando sua montagem para coleta..
Riscos
-O LDcinquenta de acetato de etila em ratos indica baixa toxicidade. No entanto, pode irritar a pele, os olhos, a pele, o nariz e a garganta..
-A exposição a níveis elevados pode causar tonturas e desmaios. Da mesma forma, a exposição a longo prazo pode afetar o fígado e os rins..
-A inalação de acetato de etila em uma concentração de 20.000 - 43.000 ppm pode causar edema pulmonar e hemorragia..
-O limite de exposição ocupacional foi definido pela OSHA em 400 ppm no ar, em média em um turno de trabalho de 8 horas..
Referências
- Steven A. Hardinger. (2017). Glossário Ilustrado de Química Orgânica: acetato de etila (EtOAc). Recuperado de: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10º edição.). Wiley plus.
- Morrison, R. T. e Boyd, R. N. (1990). Quimica Organica. (5ta edição). Editorial Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Acetato de etila. Recuperado de: en.wikipedia.org
- Algodão S. (s.f.). Acetato de etila. Recuperado de: chm.bris.ac.uk
- PubChem. (2019). Acetato de etila. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Aplicações e usos do acetato de etila. Recuperado de: foodsweeteners.com
- Departamento de Saúde de Serviços para Idosos de Nova Jersey. (2002). Acetato de etila. [PDF]. Recuperado de: nj.gov

Ainda sem comentários