
Estrutura, propriedades, síntese, usos do acetato de sódio

O acetato de sódio é um sal de sódio do ácido acético cuja fórmula molecular é CdoisH3OUdoisN / D. É um pó branco deliquescente, essencialmente sob duas formas: anidro e tri-hidratado. Ambos são muito solúveis em água, o solvente universal; mas não tão solúvel em álcoois ou acetona.
A forma anidra possui densidade, ponto de fusão e ponto de ebulição com valores superiores aos apresentados pela forma trihidratada do acetato de sódio. Isso ocorre porque as moléculas de água interferem nas interações dos íons Na.+ e CH3COO-.

O acetato de sódio é estável, especialmente quando armazenado entre 2 e 8 ° C; mas é suscetível à ação de agentes oxidantes fortes e halogênios.
Pode ser preparado pela reação do bicarbonato de sódio com o ácido acético. Além disso, com a reação do ácido acético com o hidróxido de sódio. Ambas as reações são simples de produzir e baratas; o primeiro pode até ser feito em casa.
Este sal é um composto pouco tóxico. Produz irritação na pele, somente após contato frequente e contínuo. É ligeiramente irritante para os olhos, mas pode irritar o trato respiratório. Não há informações sobre um efeito nocivo de sua ingestão..
Possui inúmeros usos e aplicações, destacando-se sua função de tamponamento do pH, juntamente com o ácido acético. O tampão acetato tem um pKa = 4,7; que confere alta eficiência na regulação do pH em um ambiente ácido com valores de pH entre 3 e 6.
Devido à sua baixa toxicidade e às suas propriedades, tem sido amplamente utilizado para realçar o sabor dos alimentos, bem como um agente que confere proteção contra a deterioração devido à sua ação contra micróbios..
Índice do artigo
- 1 Estrutura do acetato de sódio
- 1.1 Cristais hidratados
- 2 propriedades
- 2.1 Nomes
- 2,2 massa molar
- 2.3 Aparência
- 2.4 Odor
- 2,5 Densidade
- 2.6 Ponto de fusão
- 2.7 Ponto de ebulição
- 2.8 Solubilidade
- 2.9 Acidez
- 2,10 Basicity
- 2.11 Índice de refração (ηD)
- 2,12 capacidade calórica
- 2,13 ponto de fulgor
- 2.14 Temperatura de auto ignição
- 2,15 pH
- 2,16 Estabilidade
- 2,17 Reações
- 3 Síntese
- 4 usos
- 4.1 Bolsas térmicas
- 4.2 Industrial
- 4.3 Uso médico
- 4,4 solução tampão de pH
- 4.5 Laboratórios de pesquisa
- 4.6 Conservação de alimentos
- 4.7 Preservação de concreto
- 5 experiências para jovens
- 5.1 Experimento 1
- 5.2 Experimento 2
- 6 Toxicidade
- 7 referências
Estrutura do acetato de sódio
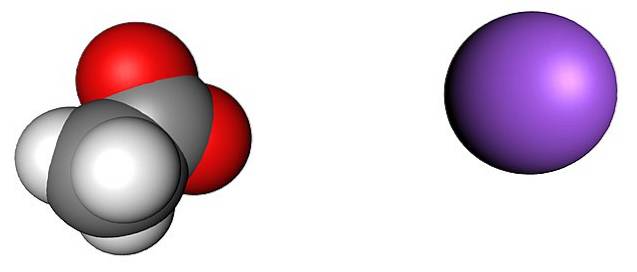
A imagem acima mostra os íons que formam os cristais de acetato de sódio anidro (sem água). A esfera roxa corresponde ao Na cation+, e o íon molecular à sua esquerda é acetato, CH3COO-, com seus átomos de oxigênio representados por esferas vermelhas.
Esses pares, de acordo com a fórmula CH3COONa, estão em uma proporção de 1: 1; para cada ânion CH3COO-, deve haver um Na cation+ atraído por sua carga negativa e vice-versa. Assim, as atrações entre eles, e as repulsões entre cargas iguais, acabam por estabelecer padrões estruturais que definem um cristal, cuja expressão mínima é a célula unitária..
A referida célula unitária, como o cristal como um todo, varia dependendo do arranjo dos íons no espaço; nem sempre é o mesmo, mesmo para o mesmo sistema cristalino. Por exemplo, o acetato de sódio anidro pode formar dois polimorfos ortorrômbicos, um dos quais é representado abaixo:
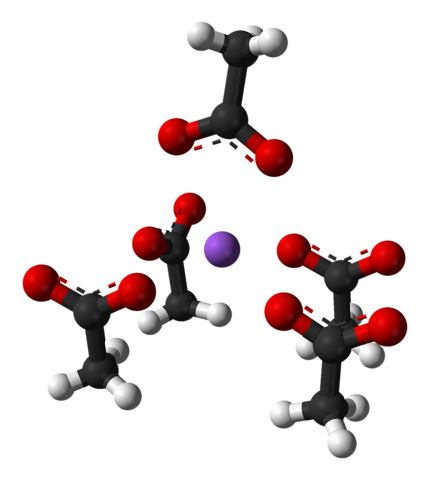
Observe a disposição dos íons: quatro íons CH3COO- eles trancam um Na+ de tal forma que eles "desenham" uma pirâmide quadrada distorcida. Cada um desses ch3COO- por sua vez, eles interagem com outro Na+ adjacente.
Cristais hidratados
O acetato de sódio tem uma grande afinidade com a água; na verdade, é deliquescente, ou seja, retém a umidade até se dissolver nela. Quanto mais alta a umidade, mais cedo ela "derrete". Isso ocorre porque tanto o CH3COO- como Na+ podem se hidratar, envolver-se com moléculas de água que orientam seus dipolos em direção às suas cargas (Na+ Ohdois, CH3COO- HOH).
Quando este sal é preparado em laboratório ou em casa, sua afinidade pela água é tal que mesmo em temperaturas normais já é obtido como um hidrato; o CH3COONa 3HdoisO. Seus cristais deixam de ser ortorrômbicos e passam a ser monoclínicos, pois passam a incorporar três moléculas de água para cada par de CH3COO- e Na+.
Propriedades
Nomes
-Acetato de sódio.
-Etanoato de sódio (IUPAC).
Massa molar
-Anidro: 82,03 g / mol.
-Tri-hidrato: 136,03 g / mol.
Aparência
Pó branco deliquescente.
Odor
Para vinagre quando aquecido até a decomposição.
Densidade
-Anidro: 1,528 g / cm3 a 20 ºC.
-Tri-hidrato: 1,45 g / cm3 a 20 ºC.
Ponto de fusão
-Anidro: 324ºC (615ºF, 597K).
-Tri-hidrato: 58 ºC (136 ºF, 331 K).
Ponto de ebulição
-Anidro: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Tri-hidrato: 122 ° C (252 ° F, 395 K). Se decompõe.
Solubilidade
Na água
-Anidro: 123,3 g / 100 mL a 20ºC.
-Tri-hidrato: 46,4 g / 100 mL a 20 ºC.
Em metanol
16 g / 100 g a 15 ºC.
Em etanol
5,3 g / 100 mL (tri-hidrato).
Em acetona
0,5 g / kg a 15 ° C.
Acidez
pKa: 24 (20 ºC).
Basicidade
pKb: 9,25. Aqui fica evidenciado que o acetato de sódio é um sal básico porque tem pKb menor que seu pKa.
Índice de refração (ηD)
1.464
Capacidade calórica
-100,83 J / mol K (anidro).
-229,9 J / mol K (tri-hidrato).
ponto de ignição
Acima de 250ºC.
Temperatura de auto ignição
600 ºC.
pH
8,9 (solução 0,1 M a 25 ° C).
Estabilidade
Estábulo. Incompatível com agentes oxidantes fortes e halogênios. Sensível à umidade.
Reações
O acetato de sódio pode formar um éster reagindo com um halogeneto de alquila; por exemplo, bromoetano:
CH3COONa + BrCHdoisCH3 => CH3COOCHdoisCH3 + NaBr
O acetato de sódio descarboxila em metano (pirólise) na presença de NaOH:
CH3COONa + NaOH => CH4 + N / DdoisCO3
A reação é catalisada por sais de césio.
Síntese
O acetato de sódio pode ser produzido de forma barata em laboratório pela reação de bicarbonato de sódio com ácido acético:
NaHCO3 + CH3COOH => CH3COONa + HdoisCO3
Essa reação é acompanhada pela presença na solução de um intenso borbulhamento, devido à decomposição do ácido carbônico em água e dióxido de carbono..
HdoisCO3 => HdoisO + COdois
Industrialmente, o acetato de sódio é produzido pela reação de ácido acético com hidróxido de sódio.
CH3COOH + NaOH => CH3COONa + HdoisOU
Formulários
Bolsas térmicas
O acetato de sódio é usado para fabricar bolsas térmicas.
Inicialmente, os cristais de sal são dissolvidos em um volume de água para preparar uma solução que se torna supersaturada..
Em seguida, a solução é aquecida a uma temperatura superior a 58 ºC, que é o seu ponto de fusão. A solução supersaturada é deixada esfriar até a temperatura ambiente e a formação de cristais não é observada; a solução é super-resfriada.
A ausência de cristais é explicada pelo fato de as moléculas do líquido estarem muito desordenadas e não terem a orientação adequada para atingir a temperatura de cristalização. O líquido está em um estado metaestável, um estado de desequilíbrio.
Dada a instabilidade do líquido super-resfriado, qualquer perturbação é suficiente para iniciar a cristalização. No caso das bolsas térmicas, um acessório mecânico é pressionado para agitar o líquido e iniciar a formação de cristais e a solidificação da solução de acetato de sódio trihidratado..
Conforme ocorre a cristalização, a temperatura aumenta. Os cristais de tri-hidrato de acetato de sódio têm a aparência de gelo, mas são quentes, por isso são chamados de "gelo quente"..
Industrial
-O acetato de sódio é usado na indústria têxtil como mordente no processo de tingimento de tecidos
-Neutraliza resíduos de ácido sulfúrico
-É utilizado no processamento de algodão para a produção de almofadas de algodão, utilizáveis em limpeza pessoal e para fins médicos
-É utilizado na decapagem de metais, antes de sua cromagem
-Colabora para que a vulcanização do cloropreno não ocorra no processo de produção da borracha sintética
-Intervém na purificação da glicose
-É usado no curtimento de couro.
Uso médico
O acetato de sódio é um dos compostos usados para fornecer eletrólitos administrados aos pacientes por via intravenosa..
É usado para corrigir os níveis de sódio em pacientes hiponatrêmicos, também na correção de acidose metabólica e alcalinização da urina..
Solução tampão de PH
É usado como regulador de pH em muitas reações enzimáticas que ocorrem entre pH 3 e pH 6.
Os diferentes pH da solução tampão de acetato são alcançados pela variação da concentração de ácido acético e acetato de sódio..
Assim, por exemplo, para obter um pH 4,5, a solução tampão tem uma concentração de ácido acético de 3,8 g / L e uma concentração de acetato de sódio anidro de 3,0 g / L..
A concentração do tampão acetato pode ser aumentada, aumentando na mesma proporção os componentes da solução necessários para se obter o pH desejado..
Tampão de acetato / acetonitrila é usado em eletroforese capilar na separação de fotoberberinas.
Laboratórios de pesquisa
-O acetato de sódio é um agente nucleofílico fraco usado na polimerização aniônica da β-lactona.
-É utilizado como reagente na ressonância magnética nuclear de macromoléculas biológicas.
-É usado na extração de DNA de células. O sódio é um cátion que interage com as cargas negativas dos fosfatos presentes no DNA, o que auxilia na condensação. Na presença de etanol, o DNA forma um precipitado que pode então se separar na camada aquosa.
Preservação de alimentos
-Ajuda a prevenir o crescimento bacteriano, além de prevenir a geração de excesso de acidez que causa a deterioração dos alimentos, mantendo assim um pH específico.
-O sódio presente no acetato aumenta o sabor dos alimentos.
-O acetato de sódio é usado na preparação de vegetais em conserva: pepino, cenoura, cebola, etc. Além disso, é utilizado na preservação de carnes..
Conservação de concreto
O concreto é danificado pela ação da água, o que encurta sua duração. O acetato de sódio atua como um agente selante do concreto que o torna impermeável, prolongando suas características iniciais.
Experiências Juvenis
Experimento 1
Um experimento simples é a síntese de acetato de sódio pela reação de bicarbonato de sódio com vinagre (ácido acético a 5%).
30 mL de vinagre são colocados em um béquer e aproximadamente 3,5 g de bicarbonato são adicionados..
Acetato de sódio e ácido carbônico são formados na reação. O ácido se decompõe em dióxido de carbono e água. A geração de dióxido de carbono produzirá um intenso borbulhar dentro da solução.
Para coletar o acetato de sódio, a água evapora, aquecendo a solução.
Experimento 2
Outro experimento simples é a formação de cristais de acetato de sódio tri-hidratado.
Para isso, cerca de 20 g de tri-hidrato de acetato de sódio são pesados e colocados em um béquer, em seguida, 10 mL de água são adicionados. A solução é aquecida a uma temperatura acima de 58 ºC.
O acetato de sódio é completamente dissolvido para garantir que a solução fique supersaturada. Anteriormente, um prato de Pietri é colocado em uma superfície fria.
O conteúdo do copo com o tri-hidrato de acetato é lentamente vertido para a placa de Pietri. A temperatura do líquido na cápsula começa a cair, mesmo abaixo do ponto de fusão, sem observar a cristalização ou solidificação do trihidrato de acetato de sódio..
Normalmente, para produzir a cristalização do tri-hidrato de acetato de sódio, uma pequena quantidade do sal é adicionada para servir como o núcleo de cristalização. Outras vezes ocorre uma pequena perturbação da solução, para iniciar a cristalização do acetato de sódio.
Os cristais de acetato de sódio tri-hidratado têm a aparência de gelo, mas se você tocá-los, notará que estão relativamente quentes. Por esse motivo, o sal é chamado de "gelo quente".
Toxicidade
O acetato de sódio é um composto tóxico muito baixo. Também não é classificado como sensibilizante cutâneo e respiratório..
Além disso, o acetato de sódio não é classificado como um agente mutagênico, carcinogênico ou tóxico reprodutivo para células germinativas..
Em suma, é um pouco irritante para os olhos. O trato respiratório pode ficar irritado após a inalação. O contato frequente e constante com a pele pode causar irritação.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- WorldOfChemicals. (16 de janeiro de 2017). Como preparar o acetato de sódio em casa? Recuperado de: medium.com
- Centro Nacional de Informações sobre Biotecnologia. (2019). Acetato de sódio. Banco de dados PubChem. CID = 517045. Recuperado de: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan e M. O. Rahman. (1976). A estrutura cristalina do tri-hidrato de acetato de sódio. Acta Cryst. B32, 87.
- Wikipedia. (2019). Acetato de sódio. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24 de janeiro de 2019). Faça gelo quente com vinagre e bicarbonato de sódio. Recuperado de: Thoughtco.com
- Livro Químico. (2017). Acetato de sódio. Recuperado de: chemicalbook.com
- Wasserman Robin. (2019). Usos do acetato de sódio. Recuperado de: livestrong.com
- Drugbank. (2019). Acetato de sódio. Recuperado de: drugbank.ca



Ainda sem comentários