
Estrutura da adiponectina, função, receptores, mecanismo de ação
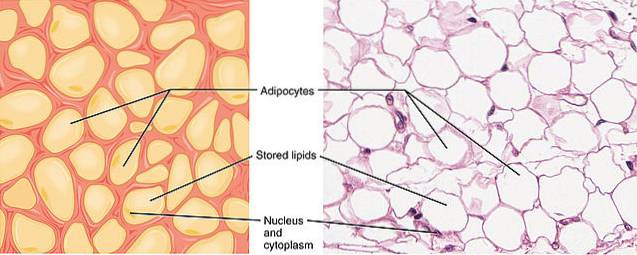
O adiponectina é uma das proteínas secretoras mais abundantes produzidas por um tipo especial de células conhecidas como adipócitos, características do tecido adiposo. É responsável por aumentar a sensibilidade à insulina e está envolvida na homeostase energética e na obesidade.
O gene da adiponectina humana foi clonado do tecido adiposo em 1996, durante experimentos de Matsuzawa, que o nomeou o transcrito-1 do gene adiposo mais abundante (apM1). transcrito 1 do gene adiposo mais abundante).
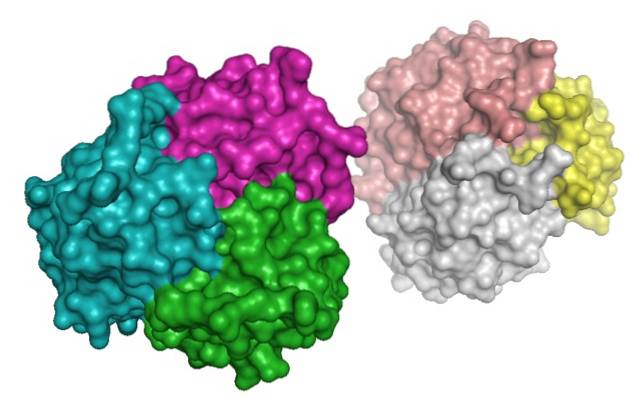
A proteína, por outro lado, foi identificada no plasma sanguíneo do mesmo ano por Nakano et al..
Esse hormônio contribui para a integração dos sinais endócrinos e metabólicos que estão relacionados ao controle da homeostase energética. Sua expressão é induzida durante a diferenciação dos adipócitos e circula no soro em concentrações relativamente altas..
Índice do artigo
- 1 Estrutura
- 2 Função
- 3 receptores
- 3.1 caderina-T
- 4 Mecanismo de ação
- 5 valores normais
- 6 referências
Estrutura
A adiponectina pertence à família do complemento 1q (C1q) e pode ser encontrada no plasma sanguíneo em uma ampla variedade de complexos multiméricos (de várias subunidades): trímeros, hexâmeros e multímeros de alto peso molecular (de mais de 18 subunidades).
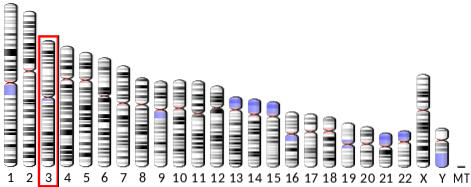
O gene que codifica a adiponectina (ADIPOQ) está localizado no braço longo do cromossomo 3 em humanos, tem 16 bases quilo e 3 exons. Sua expressão rende uma proteína solúvel em água, composta por 247 resíduos de aminoácidos e peso molecular pouco inferior a 30 kDa, com ponto isoelétrico de 5,42.
É composto por quatro domínios: uma sequência de sinal na extremidade N-terminal, uma região variável, um domínio de colágeno (cAd) e um domínio C-terminal globular..
Na porção amino terminal é distinguida uma sequência semelhante ao colágeno conhecida como domínio do colágeno, que é uma região de grande importância para a formação de multímeros e é altamente conservada entre as espécies..
A hidroxilação e glicosilação concomitante de resíduos de lisina no domínio do colágeno dessa proteína é o que possibilita a formação de trímeros, que ao mesmo tempo podem se associar para formar hexâmeros e outros complexos de alto peso molecular..
Esses complexos aparentemente têm especificidade de tecido "alvo", por exemplo, complexos de alto peso molecular são mais ativos no fígado, enquanto trímeros e hexâmeros agem sem muita distinção em uma ampla variedade de tecidos..
A região globular no terminal C, chamada de domínio globular ou gAd, é homóloga a proteínas como o colágeno VIII e o colágeno X, bem como ao fator de complemento C1q..
Função
Em linhas gerais, pensa-se que o hormônio adiponectina atua de forma relevante na regulação do metabolismo de lipídios e carboidratos em diversos tecidos sensíveis à insulina..
Este atua em diferentes tecidos do corpo, uma vez que seus receptores são expressos em diversos locais. Produzida exclusivamente por adipócitos, a adiponectina promove a biossíntese de ácidos graxos e a inibição da gliconeogênese no fígado, um dos tecidos onde se encontra seu receptor AdipoR2..
No músculo esquelético, onde se encontram os receptores AdipoR1 e AdipoR2, promove a oxidação de ácidos graxos e a entrada de glicose nas células musculares.
A adiponectina também melhora a resistência à insulina em alguns pacientes, pois reduz a quantidade de gordura intracelular ao ativar a oxidação de ácidos graxos no músculo e no fígado..
Certos autores sugerem que esse hormônio atue também como antioxidante, antiinflamatório e anti-arteriosclerótico..
Receptores
Os diferentes complexos de adiponectina parecem ter alguma preferência sobre tecidos específicos. Essas interações específicas do tecido ocorrem em resposta à expressão diferencial de diferentes tipos de receptores de adiponectina..
Os receptores de adiponectina (AdipoR) são receptores acoplados à proteína G pertencentes à família de receptores conhecida como PAQR. Dois tipos são conhecidos: AdipoR1 e AdipoR2. Ambos mantêm seus domínios N-terminais no espaço intracelular, enquanto seus domínios C-terminais são expostos em direção ao espaço extracelular..
Os receptores do tipo AdipoR1 têm 375 aminoácidos e peso molecular de 42 kDa, enquanto os receptores do tipo AdipoR2 têm 311 aminoácidos e um peso de 35 kDa. Ambos possuem 7 domínios transmembrana, ou seja, sua estrutura atravessa a membrana plasmática das células onde se encontram 7 vezes..
Há cerca de 70% de homologia de sequência entre os dois receptores, com exceção de suas extremidades N-terminais, que são específicas para cada um..
Tanto o AdipoR1 quanto o AdipoR2 são expressos em todos os tecidos, embora sua abundância varie de um para o outro. AdipoR1 está principalmente no músculo esquelético e AdipoR2 está tanto no músculo esquelético quanto no fígado.
Caderina-t
Há também um receptor "putativo" para a adiponectina conhecido como caderina-T, que consiste em uma única molécula de caderina que perdeu seus domínios citosólico e transmembrana e está ligada à superfície celular através de âncoras de glicosilfosfatidilinositol (âncoras GPI).
Este “receptor” da adiponectina é expresso em todos os tecidos, mas tem sido relatado com maior abundância no coração, nas artérias aórtica, carótida e ilíaca e nas artérias renais..
Mecanismo de ação
Embora os mecanismos de produção e liberação de adiponectina na corrente sanguínea não sejam totalmente compreendidos, acredita-se que a via de transdução de sinal começa com a ligação da adiponectina aos receptores de membrana em suas células-alvo..
Esse hormônio induz a ativação da proteína quinase ativada por AMP (AMPK), que ocorre por meio de uma proteína "adaptadora" que contém um domínio de homologia à plecstrina (típico de proteínas envolvidas em processos de sinalização celular) e um domínio de ligação à fosfotirosina (PTB) , além de um motivo de fechamento de leucina 1 (APPL).
O domínio APPL é aquele que se liga à porção intracelular de qualquer um dos dois receptores AdipoR. Uma pequena proteína GTPase conhecida como Rab5 se liga a um dos locais do domínio de fechamento da leucina e promove a translocação da membrana de GLUT4, um transportador de glicose regulado pela insulina..
Além disso, a adiponectina atua sobre um fator de transcrição nuclear conhecido como PPARα, importante do ponto de vista do metabolismo de proteínas, lipídios e carboidratos, bem como na diferenciação e desenvolvimento celular..
Valores normais
Os valores normais relatados para a adiponectina no plasma sanguíneo correspondem a complexos multiméricos desta proteína, cuja faixa de concentração está entre 5 e 20 microgramas por mililitro, embora concentrações de até 30 microgramas por mililitro também tenham sido documentadas..
Diante do exposto, vale ressaltar que as concentrações de adiponectina no plasma variam significativamente; as mulheres, por exemplo, tendem a ter valores mais elevados que os homens.
Os valores desse hormônio dependem muito do estado nutricional, da presença ou ausência de qualquer patologia, etc., mas geralmente são inversamente correlacionados com a adiposidade e com condições como doenças cardiovasculares, hipertensão e síndromes metabólicas.
Existem relatórios que garantem que as concentrações plasmáticas de adiponectina diminuem em pacientes que sofrem de condições patológicas, como resistência à insulina e obesidade.
Referências
- Chandran, M., Phillips, S. A., Ciaraldi, T., & Henry, R. R. (2003). Adiponectina: mais do que apenas outro hormônio das células gordurosas? Cuidados com diabetes, 26 (8), 2442-2450.
- Hirako, S. (2016). Adiponectina. Em Handbook of Hormones (pp. 308-e34B). Academic Press.
- Kadowaki, T., & Yamauchi, T. (2005). Receptores de adiponectina e adiponectina. Revisões endócrinas, 26 (3), 439-451.
- Kadowaki, T., Yamauchi, T., Kubota, N., Hara, K., Ueki, K., & Tobe, K. (2006). Adiponectina e receptores de adiponectina na resistência à insulina, diabetes e síndrome metabólica. The Journal of Clinical Research, 116 (7), 1784-1792.
- Klein, S., & Romijn, J. A. (2007). Capítulo 35-Obesidade. Williams Textbook of Endocrinology, 11, 1568-1569.
- Steyn, F. J., & Chen, C. (2013). Adiponectina.


Ainda sem comentários