
Variação de afinidade eletrônica na tabela periódica e exemplos
O Afinidade eletrônica ou eletroafinidade é uma medida da variação energética de um átomo na fase gasosa quando ele incorpora um elétron à sua camada de valência. Uma vez que o elétron foi adquirido pelo átomo A, o ânion A resultante- ele pode ou não ser mais estável do que seu estado inicial. Portanto, esta reação pode ser endotérmica ou exotérmica..
Por convenção, quando o ganho do elétron é endotérmico, o valor de afinidade do elétron é atribuído a um sinal positivo "+"; Por outro lado, se for exotérmico - isto é, libera energia - este valor recebe um sinal negativo "-". Em quais unidades esses valores são expressos? Em kJ / mol, ou em eV / átomo.
Se o elemento estivesse em uma fase líquida ou sólida, seus átomos interagiriam uns com os outros. Isso faria com que a energia absorvida ou liberada, devido ao ganho eletrônico, fosse dispersa entre todos esses, produzindo resultados não confiáveis..
Por outro lado, na fase gasosa, presume-se que estejam isolados; em outras palavras, eles não interagem com nada. Então, os átomos envolvidos nesta reação são: A (g) e A-(g). Aqui (g) denota que o átomo está na fase gasosa.
Índice do artigo
- 1 Primeira e segunda afinidades eletrônicas
- 1.1 Primeiro
- 1,2 segundo
- 2 Como a afinidade eletrônica varia na tabela periódica
- 2.1 Variação pelo núcleo e o efeito de blindagem
- 2.2 Variação por configuração de elétrons
- 3 exemplos
- 3.1 Exemplo 1
- 3.2 Exemplo 2
- 4 referências
Primeira e segunda afinidades eletrônicas
Primeiro
A reação de ganho eletrônico pode ser representada como:
A (g) + e- => A-(g) + E, ou como A (g) + e- + E => A-(g)
Na primeira equação, E (energia) é encontrado como um produto no lado esquerdo da seta; e na segunda equação a energia é contabilizada como reativa, estando localizada no lado direito. Ou seja, o primeiro corresponde a um ganho eletrônico exotérmico e o segundo a um ganho eletrônico endotérmico.
No entanto, em ambos os casos, é apenas um elétron que é adicionado à camada de valência do átomo A..
Segundo
Também é possível que, uma vez que o íon negativo A é formado-, ele absorve outro elétron novamente:
PARA-(g) + e- => Adois-(g)
Porém, os valores para a afinidade do segundo elétron são positivos, uma vez que as repulsões eletrostáticas entre o íon negativo A devem ser superadas- e o elétron de entrada e-.
O que determina que um átomo gasoso "receba" melhor um elétron? A resposta encontra-se essencialmente no núcleo, no efeito de blindagem das camadas eletrônicas internas e na camada de valência..
Como a afinidade eletrônica varia na tabela periódica
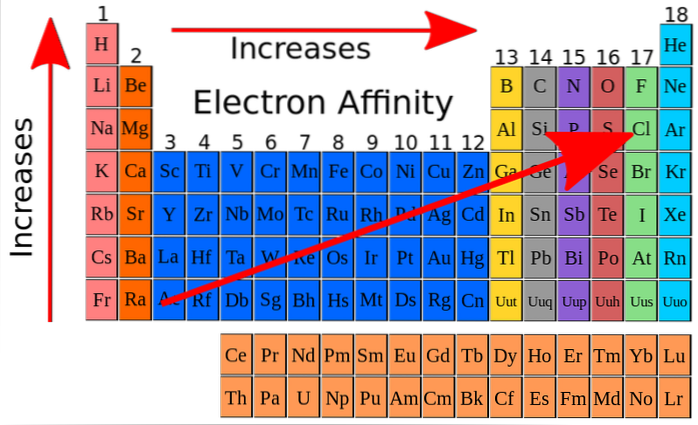
Na imagem superior, as setas vermelhas indicam as direções em que aumenta a afinidade eletrônica dos elementos. A partir disso, a afinidade eletrônica pode ser entendida como mais uma das propriedades periódicas, com a peculiaridade de apresentar muitas exceções..
A afinidade eletrônica aumenta de forma ascendente através dos grupos e também aumenta da esquerda para a direita ao longo da tabela periódica, especialmente na vizinhança do átomo de flúor. Esta propriedade está intimamente relacionada ao raio atômico e aos níveis de energia de seus orbitais..
Variação por núcleo e efeito de proteção
O núcleo tem prótons, que são partículas carregadas positivamente que exercem uma força atrativa sobre os elétrons do átomo. Quanto mais próximos os elétrons estão do núcleo, maior é a atração que sentem. Assim, à medida que aumenta a distância do núcleo aos elétrons, menores são as forças de atração..
Além disso, os elétrons da camada interna ajudam a "blindar" o efeito do núcleo sobre os elétrons das camadas mais externas: os elétrons de valência..
Isso se deve às próprias repulsões eletrônicas entre suas cargas negativas. No entanto, este efeito é neutralizado pelo aumento do número atômico Z.
Como isso se relaciona com a afinidade eletrônica? Que um átomo gasoso A terá uma tendência maior de ganhar elétrons e formar íons negativos estáveis quando o efeito de proteção for maior do que as repulsões entre o elétron que chega e aqueles da camada de valência.
O oposto ocorre quando os elétrons estão muito distantes do núcleo e as repulsões entre eles não prejudicam o ganho eletrônico..
Por exemplo, descer em um grupo "abre" novos níveis de energia, que aumentam a distância entre o núcleo e os elétrons externos. É por esta razão que ao ascender pelos grupos as afinidades eletrônicas aumentam..
Variação por configuração de elétron
Todos os orbitais têm seus níveis de energia, portanto, se o novo elétron ocupar um orbital de maior energia, o átomo precisará absorver energia para que isso seja possível..
Além disso, a forma como os elétrons ocupam os orbitais pode ou não favorecer o ganho eletrônico, distinguindo assim as diferenças entre os átomos..
Por exemplo, se todos os elétrons estão desemparelhados nos orbitais p, a inclusão de um novo elétron causará a formação de um par emparelhado, que exerce forças repulsivas sobre os outros elétrons..
Este é o caso do átomo de nitrogênio, cuja afinidade eletrônica (8kJ / mol) é menor do que para o átomo de carbono (-122kJ / mol).
Exemplos
Exemplo 1
A primeira e a segunda afinidade eletrônica para o oxigênio são:
O (g) + e- => O-(g) + (141kJ / mol)
OU-(g) + e- + (780kJ / mol) => Odois-(g)
A configuração eletrônica para O é 1sdois2sdois2 P4. Já existe um par de elétrons emparelhado, que não consegue superar a força atrativa do núcleo; portanto, o ganho eletrônico libera energia após a formação do íon O estável.-.
No entanto, embora Odois- Possui a mesma configuração do gás nobre néon, suas repulsões eletrônicas excedem a força atrativa do núcleo, e para permitir a entrada do elétron é necessária uma contribuição de energia.
Exemplo 2
Se as afinidades eletrônicas dos elementos do grupo 17 forem comparadas, será obtido o seguinte:
F (g) + e- = F-(g) + (328 kJ / mol)
Cl (g) + e- = Cl-(g) + (349 kJ / mol)
Br (g) + e- = Br-(g) + (325 kJ / mol)
I (g) + e- = Eu-(g) + (295 kJ / mol)
De cima para baixo - descendo no grupo - os raios atômicos aumentam, assim como a distância entre o núcleo e os elétrons externos. Isso causa um aumento nas afinidades eletrônicas; entretanto, o flúor, que deveria ter o maior valor, é superado pelo cloro.
Por quê? Esta anomalia demonstra o efeito das repulsões eletrônicas sobre a força atrativa e baixa blindagem..
Por ser um átomo muito pequeno, o flúor "condensa" todos os seus elétrons em um pequeno volume, causando uma repulsão maior no elétron que entra, ao contrário de seus congêneres mais volumosos (Cl, Br e I)..
Referências
- Bibliotecas de Química. Afinidade de elétrons. Obtido em 4 de junho de 2018, em: chem.libretexts.org
- Jim Clark. (2012). Afinidade de elétrons. Obtido em 4 de junho de 2018, em: chemguide.co.uk
- Carl R. Nave. Afinidades eletrônicas dos elementos do grupo principal. Obtido em 4 de junho de 2018, em: hyperphysics.phy-astr.gsu.edu
- Prof. N. De Leon. Afinidade de elétrons. Obtido em 4 de junho de 2018, em: iun.edu
- Helmenstine, Anne Marie, Ph.D. (27 de maio de 2016). Definição de afinidade de elétron. Obtido em 4 de junho de 2018, em: Thoughtco.com
- Cdang. (3 de outubro de 2011). Tabela periódica de afinidade de elétrons. [Figura]. Obtido em 4 de junho de 2018, em: commons.wikimedia.org
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 227-229.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição., P. 29). Mc Graw Hill.


Ainda sem comentários