
Base, preparação e usos do ágar Hektoen

O Agar Hektoen ou ágar entérico Hektoen é um meio de cultura sólido, seletivo e diferencial. Foi criado no Instituto Hektoen por King e Metzger para o isolamento de bactérias enteropatogênicas dos gêneros Shigella e Salmonella.
O meio é composto de proteose peptona, extrato de levedura, sais biliares, lactose, sacarose, salicina, tiossulfato de sódio, cloreto de sódio, citrato de ferro, citrato de amônio, azul de bromotimol, fucsina ácida e ágar. Essa formulação permite diferenciar os gêneros Shigella e Salmonella do restante das bactérias capazes de crescer neste meio..
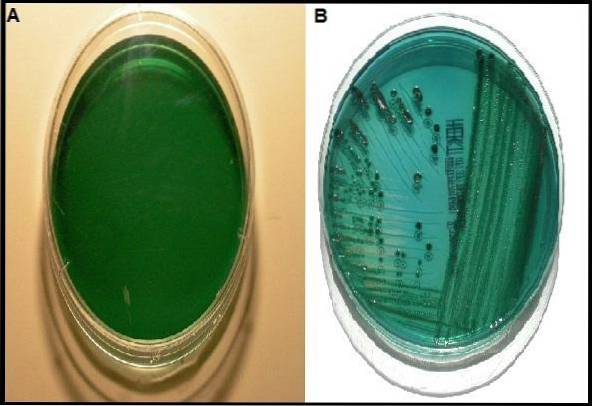
Embora existam outros meios com a mesma função do ágar Hektoen, ele tem uma vantagem maior em comparação com outros meios, principalmente quando se deseja recuperar espécies de Shigella..
As espécies de ambos os sexos produzem graves problemas gastrointestinais em humanos devido ao consumo de alimentos contaminados; portanto, a transmissão é fecal - oral. É por isso que o uso do ágar Hektoen é indicado principalmente na análise microbiológica de fezes e amostras de alimentos..
Índice do artigo
- 1 justificativa
- 2 Preparação
- 3 Use
- 4 Controle de qualidade
- 5 limitações
- 6 referências
Base
O ágar Hektoen contém peptonas e extrato de levedura como fonte de nutrientes, fornecendo os elementos essenciais para o desenvolvimento microbiano.
No entanto, também possui sais biliares que atuam inibindo o crescimento de algumas bactérias, especialmente Gram positivas e algumas Gram negativas. É por esta razão que é considerado um meio seletivo.
Por outro lado, o ágar Hektoen é um meio diferencial. Essa propriedade é conferida pela presença de carboidratos fermentáveis como lactose, sacarose e salicina, juntamente com o sistema indicador de pH, representado pelo azul de bromotimol e fucsina ácida..
Todas as bactérias capazes de crescer neste meio que não pertençam ao gênero Salmonella e Shigella desenvolverão colônias de salmão ou laranja, com exceção do gênero Proteus. Isso se deve à fermentação de um ou mais dos carboidratos presentes, o que acidifica o meio, o que faz com que o indicador de pH mude..
Por sua vez, os gêneros Shigella e Salmonella não são capazes de fermentar nenhum dos carboidratos presentes, utilizando apenas peptonas como fonte de energia, o que alcaliniza o meio e, portanto, suas colônias são azul esverdeadas..
Bactérias capazes de formar sulfeto de hidrogênio (gás incolor) também podem ser distinguidas neste meio. O tiossulfato de sódio atua como fonte de enxofre, enquanto o citrato de ferro é o agente de desenvolvimento. Ambos os compostos possibilitam a formação de um precipitado negro de sulfeto de ferro que evidencia a reação..
O precipitado preto no centro da colônia com um halo transparente ao redor dá uma aparência de olho de peixe. Esta característica sugere a presença do gênero Salmonella..
Por fim, o cloreto de sódio mantém o equilíbrio osmótico e o ágar confere consistência sólida ao meio..
Preparação
Pesar 76 g do meio desidratado e dissolver em um litro de água destilada. Agite a mistura vigorosamente e deixe descansar por 10 a 15 minutos. Pode ser aquecido e fervido, dando movimentos giratórios até sua total dissolução. Este meio não é autoclavado.
Quando o meio atinge uma temperatura de aproximadamente 45 ° C, despeje um volume de 20 ml diretamente em placas de Petri estéreis..
O ágar pode solidificar. Nesse momento, eles estão prontos para uso. Recomenda-se usá-los imediatamente. Se isso não for possível, eles são armazenados na geladeira até o uso..
As placas devem ser removidas da geladeira com antecedência antes da semeadura para trazê-las à temperatura ambiente.
O pH do meio deve ser 7,5 ± 0,2. A cor do meio desidratado é roxa e o meio preparado é verde acastanhado.
Usar
O uso do ágar Hektoen é recomendado para a pesquisa de bactérias do gênero Shigella e Salmonella em amostras de fezes e alimentos..
A possibilidade de isolamento dessas bactérias aumenta consideravelmente se a amostra for previamente enriquecida em caldos especiais, como caldo de selenita, caldo de selenito de cistina, caldo de tetrationato, etc..
O inóculo deve ser forte e a semeadura é feita por estrias. As placas são incubadas a 37 ° C por 24 a 48 horas em aerobiose.
A incubação por 48 horas é recomendada, pois as características das colônias são mais claras para sua interpretação e diferenciação neste momento..
Controle de qualidade
Para realizar o controle de qualidade neste meio, cepas bacterianas certificadas são utilizadas, tais como: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Shigella flexneri ATCC 12022 e Shigella Sonnei ATCC 25931.
Os resultados esperados são os seguintes: Salmonella typhimurium e Salmonella enteritidis eles devem desenvolver colônias azul-esverdeadas com ou sem um centro preto. Enquanto a espécie Shigella crescerá como colônias verde-azuladas.
Cepas de Escherichia coli ATCC 29212, Proteus mirabilis, Klebsiella pneumoniae ATCC 700603, Enterococcus faecalis ATCC 29212 e Staphylococcus aureus ATCC 25923.
Nestes casos, as características observadas são as seguintes: E. coli Y K. pneumoniae as colônias se desenvolverão nesta cor salmão médio a laranja, com um precipitado da mesma cor ao redor. Considerando que, Proteus desenvolverá colônias azul-esverdeadas com ou sem um centro preto..
Enquanto que S. aureus Y E. faecalis deve ser inibido, às vezes E. faecalis consegue crescer como colônias muito pequenas e amarelas.
Por outro lado, como este meio não é autoclavado, é importante avaliar a esterilidade do meio. Portanto, de cada lote preparado, uma a duas placas não inoculadas devem ser incubadas a 37 ° C por 24 horas em aerobiose..
Obviamente, nenhum crescimento de qualquer tipo é esperado na placa.
Limitações
-Espécies de Proteus podem se desenvolver neste meio e as características de suas colônias podem ser confundidas com espécies de Salmonella ou Shigella. Por esse motivo, qualquer colônia suspeita deve ser confirmada com testes bioquímicos..
-É necessário acompanhar o uso desse meio com outros ágares menos seletivos, pois se o microrganismo procurado for encontrado em baixas concentrações, pode não se desenvolver neste meio..
-Não superaqueça durante a preparação, pois o calor excessivo altera a composição do meio.
-Colônias de Salmonella que fermentam lactose podem ter uma aparência incomum e passar despercebidas.
Referências
- Colaboradores da Wikipedia. Agar entérico Hektoen. Wikipédia, a enciclopédia livre. 13 de março de 2019, 23:38 UTC. Disponível em: .wikipedia.org / Acessado em 16 de março de 2019.
- Laboratórios BD. BD Hektoen Enteric Agar (HE Agar). 2013. Disponível em: bd.com
- Britannia Laboratories. Hektoen Enteric Agar. 2015. Disponível em: britanialab.com
- Difco Francisco Soria Melguizo Laboratories. Agar Hektoen. Disponível em: f-soria.es
- Disco & BBL Manual, Hektoen Enteric Agar. 2ª Edição. Disponível em: bd.com/europe



Ainda sem comentários