
Antecedentes, preparação e usos do Agar LIA (Ferro Lisina)
O Ágar LIA (Ferro Lisina) é um teste bioquímico utilizado para a identificação de bactérias da família Enterobacteriaceae. Este meio foi criado por Edwards e Fife, com base na fórmula de Falkow.
Originalmente, esse teste era um caldo contendo peptonas, extrato de levedura, glicose, L-lisina, roxo de bromocresol e água destilada. Edwards e Fife adicionaram ágar-ágar, citrato de amônio férrico e tiossulfato de sódio..
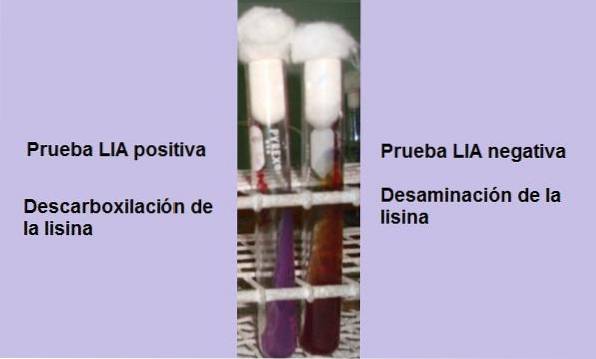
O teste consiste basicamente em demonstrar a presença da enzima lisina descarboxilase, capaz de reagir com o grupo carboxila do aminoácido L-lisina. A desaminação do aminoácido também pode ocorrer devido à presença da enzima lisina desaminase..
Além disso, a composição do meio permite evidências da capacidade de alguns gêneros bacterianos de produzir sulfeto de hidrogênio. Por fim, também é possível observar a geração ou não de gás no meio.
Índice do artigo
- 1 justificativa
- 1.1 Peptonas e extrato de levedura
- 1,2 glicose
- 1,3 L-lisina
- 1,4 indicador de pH (roxo de bromocresol)
- 1.5 Citrato férrico de amônio e tiossulfato de sódio
- 2 Interpretação do teste
- 2.1 Descarboxilação de lisina
- 2.2 Desaminação de lisina
- 2.3 Produção de sulfeto de hidrogênio (H2S)
- 3 Registro de resultados
- 4 Preparação
- 5 usos
- 6 referências
Base
Peptonas e extrato de levedura
Como a maioria dos meios de cultura, o ágar ferro lisina contém componentes que fornecem a fonte de nutrientes necessários para o crescimento bacteriano. Esses componentes são representados por peptonas e extrato de levedura.
Glicose
Da mesma forma, este ágar contém glicose como um carboidrato fermentável. Todas as bactérias da família Enterobacteriaceae são conhecidas por fermentar glicose.
Essa etapa é fundamental, pois será responsável pela acidificação do meio, condição essencial para que a enzima lisina descarboxilase -se presente- atue sobre seu substrato..
Em alguns gêneros bacterianos, a produção de gás devido à fermentação da glicose pode ser observada.
O gás é evidenciado quando há deslocamento do ágar no tubo, deixando um espaço vazio no fundo do tubo, ou por fratura do meio em duas ou mais porções.
L-lisina
Uma vez que a lisina é descarboxilada, uma diamina (cadaverina) e dióxido de carbono são formados.
A descarboxilação ocorre na presença de coenzima de fosfato de piridoxal. Esta reação é irreversível.
Indicador de pH (roxo de bromocresol)
Todas as mudanças de pH que ocorrem no meio devido às várias reações são detectadas pelo indicador de pH roxo do bromocresol..
Nesse sentido, quando há acidificação o meio fica amarelo, e quando há alcalinização o meio retorna à sua cor roxa ou roxa original..
Quando ocorre a desaminação da lisina devido à presença da enzima lisina desaminase, uma cor avermelhada é formada na superfície, típica dos gêneros Proteus, Providencia e algumas espécies de Morganella.
Isso se deve ao fato do ácido alfa-ceto-carbônico ser formado durante o processo de desaminação, que reage com o citrato de amônio na presença de oxigênio, causando a referida cor..
Citrato férrico de amônio e tiossulfato de sódio
Por outro lado, as bactérias produtoras de sulfeto de hidrogênio serão evidenciadas pela presença de tiossulfato de sódio (fonte de enxofre) e citrato férrico de amônio, que é o criador do HdoisS.
As bactérias que possuem a enzima tiossulfato redutase têm a capacidade de atuar reduzindo o tiossulfato de sódio presente, formando sulfito e sulfeto de hidrogênio (HdoisS).
Este último é um gás incolor, mas quando reage com o sal de ferro forma sulfeto metálico ferroso, que é um composto insolúvel (precipitado preto visível).
No entanto, a capacidade de formação de HdoisS com este meio não é muito confiável, porque algumas bactérias lisina descarboxilase negativas capazes de produzir HdoisS não formará o precipitado preto, pois a acidez do meio interfere. Portanto, é recomendável verificar com outros meios de comunicação que contenham ferro.
Interpretação do teste
Descarboxilação de lisina
Os tubos devem ser lidos após as 24 horas de incubação, caso contrário, existe o risco de interpretação errônea da reação, relatando falsos negativos.
Deve ser lembrado que a primeira reação que ocorrerá será a fermentação da glicose, pois todos os tubos após 10 a 12 horas ficarão amarelos..
Se ao final do tempo de incubação (24 horas) for observado um fundo amarelo com uma superfície roxa ou roxa, a reação é negativa. A cor púrpura da superfície corresponde à alcalinização do meio pelo uso de peptonas..
Uma reação positiva é aquela em que o fundo e a superfície do tubo ficam totalmente roxos, ou seja, ele retorna à cor original..
Portanto, quem determina a positividade do teste é a base ou background do meio. Em caso de dúvida sobre a cor, pode ser comparado a um tubo LIA não inoculado.
Desaminação de lisina
Um tubo que mostra a desaminação da lisina terá uma superfície marrom avermelhada e um fundo amarelo (ácido), ou todo o tubo terá uma cor marrom avermelhada..
Esta reação é interpretada como negativa para a descarboxilação da lisina, mas positiva para a desaminação da lisina..
Esta reação é definida e interpretada na moldura.
Produção de sulfeto de hidrogênio (HdoisS)
Uma reação positiva é observada pelo aparecimento de um precipitado preto em todo ou parte do meio. Normalmente entre a borda do chanfro e a base.
Se o precipitado ocorrer ao longo do tubo, ele não mostrará as outras reações que ocorrem no meio..
Registro de resultados
Ao interpretar o teste, os resultados são registrados da seguinte forma:
A moldura é lida primeiro, depois a parte inferior ou bloco e, em seguida, a produção de HdoisSim, e finalmente a produção de gás.
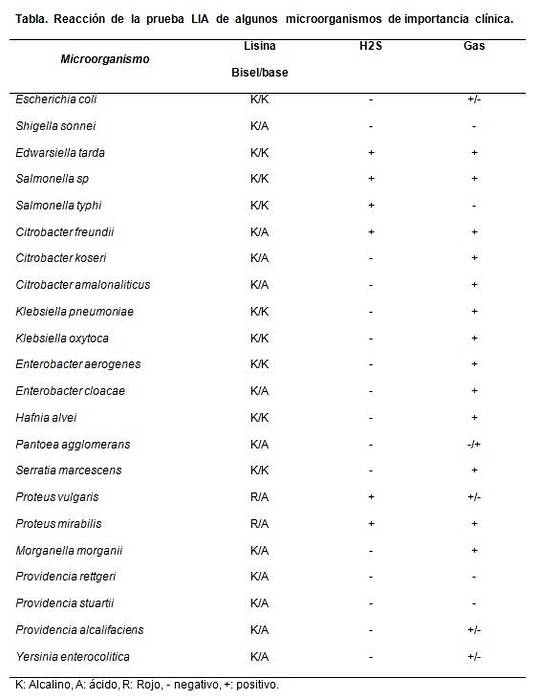
Exemplo: K / A + (-). Isso significa:
- K: moldura alcalina (cor roxa)
- A: Fundo ácido (amarelo), ou seja, reação de descarboxilação negativa e desaminação negativa.
- +: Produção de sulfeto de hidrogênio
- (-): Sem gás.
Preparação
Pesar 35 g do meio de lisina ágar ferro desidratado e dissolver em um litro de água destilada..
Aquecer até que o ágar se dissolva completamente; para isso, deixe ferver por um minuto, mexendo sempre. Distribua 4 ml do meio em tubos de ensaio 13/100 com tampas de algodão.
Esterilize em autoclave a 121 ° C por 15 minutos. Retire da autoclave e deixe descansar em ângulo, de modo que haja uma base profunda e um bisel curto.
Conservar no refrigerador 2-8 ° C. Deixe aquecer antes de semear a cepa bacteriana.
O meio desidratado é bege e o meio preparado é roxo avermelhado..
O pH final do meio preparado é 6,7 ± 0,2
O meio fica amarelo com pH igual ou inferior a 5,2 e é roxo em pH 6,5 e acima.
Formulários
Este teste, junto com outros testes bioquímicos, é usado para identificar bacilos da família Enterobacteriaceae..
O meio é semeado com um laço reto ou agulha, um ou dois furos são feitos no fundo do tubo e, em seguida, a superfície do meio é marcada em zigue-zague..
Incubar por 24 horas a 35-37 ° C em aerobiose. Se necessário, incube por mais 24 horas..
É principalmente útil para diferenciar espécies de Citrobacter lactose negativas de Salmonellas sp.
Referências
- Mac Faddin J. (2003). Testes bioquímicos para identificação de bactérias de importância clínica. 3ª ed. Editorial Panamericana. Bons ares. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W., Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico. 5ª ed. Editorial Panamericana S.A. Argentina.
- Britannia Laboratories. Agar de ferro lisina. 2015. Disponível em: britanialab.com
- Laboratórios BD. BBL Lysine Iron Agar Slants. 2007. Disponível em: bd.com
- Valtek Laboratories. Médio L.I.A. 2009. Disponível em: andinamedica.com



Ainda sem comentários