
Estrutura, propriedades, usos e riscos do álcool isoamílico
O álcool isoamílico é um composto orgânico cuja fórmula é (CH3)doisCHCHdoisCHdoisOH. Quimicamente falando, é um álcool primário ramificado e constitui um dos isômeros do pentanol, chamados álcoois amílicos (C5H12OU).
Como muitos álcoois de baixo peso molecular, é um líquido incolor à temperatura ambiente. Isso permite e facilita seu uso como solvente para diversas aplicações; ainda mais, quando não exerce muitos efeitos negativos sobre o ecossistema após ser descartado.
Embora seja um material intermediário na síntese do acetato de amila para a produção de fragrâncias artificiais de banana, seu próprio cheiro é desagradável e semelhante ao da pera..
Além de servir como solvente para múltiplas substâncias biológicas, e como intermediário na síntese de outros acetatos, reduz a tensão superficial de certas formulações industriais, evitando a formação de espumas. Portanto, é usado em sistemas microemulsificados.
Quanto à sua origem natural, o álcool isoamílico tem sido encontrado nos feromônios de vespas e nas trufas negras, um tipo de fungo localizado no sudeste da Europa..
Índice do artigo
- 1 Estrutura do álcool isoamílico
- 1.1 Interações intermoleculares
- 2 propriedades
- 2.1 Aparência física
- 2.2 Olfato e sabor
- 2,3 massa molar
- 2.4 Densidade
- 2,5 densidade de vapor
- 2.6 Pressão de vapor
- 2.7 Ponto de ebulição
- 2.8 Ponto de fusão
- 2.9 Ponto de fulgor
- 2.10 Temperatura de autoignição
- 2.11 Solubilidade
- 2,12 Viscosidade
- 2.13 Tensão superficial
- 2.14 Índice de refração
- 2,15 capacidade de calor
- 3 usos
- 3.1 Matéria-prima
- 3.2 Fragrâncias
- 3.3 Desespumante
- 3.4 Extrações
- 4 riscos
- 4.1 Armazenamento e reatividade
- 4.2 Saúde
- 5 referências
Estrutura do álcool isoamílico
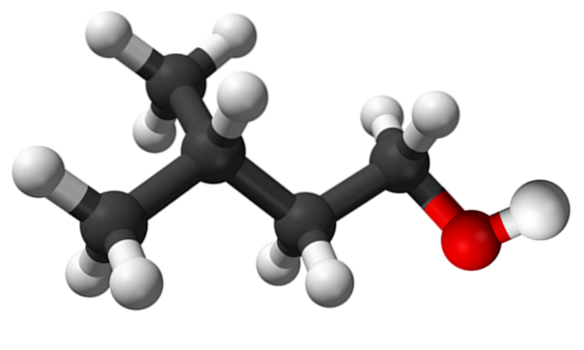
A imagem superior mostra a molécula de álcool isoamílico representada com um modelo de esferas e barras. À direita dela, a esfera avermelhada corresponde ao átomo de oxigênio do grupo OH, característico de todos os álcoois; enquanto à esquerda está o esqueleto de carbono com um grupo metil, CH3, estrutura ramificada.
Do ponto de vista molecular, este composto é dinâmico porque possui átomos com hibridizações sp.3, facilitando a rotação de seus links; contanto que não faça com que OH e CH eclipsem3.
Vale ressaltar também sua característica anfifílica: possui extremidade apolar ou hidrofóbica, formada pela cadeia (CH3)doisCHCHdoisCHdois-, e uma cabeça polar ou hidrofílica, o grupo OH. Essa definição de duas áreas específicas de polaridades diferentes torna esse álcool um surfactante; e, portanto, sua aplicação para microemulsões.
Interações intermoleculares
Dada a presença do grupo OH, a molécula de álcool isoamílico exibe um momento de dipolo permanente. Consequentemente, as forças dipolo-dipolo conseguem ligar suas moléculas, responsáveis pelas propriedades físicas e mensuráveis do líquido, bem como por seu odor..
Embora a ramificação das cadeias principais diminua as interações efetivas entre as moléculas, as ligações de hidrogênio neste álcool compensam essa diminuição, fazendo com que o líquido ferva a 131 ° C, temperatura acima do ponto de ebulição da água..
O mesmo não acontece com seu sólido ou "gelo", que derrete a -117 ° C, indicando que suas interações intermoleculares não são fortes o suficiente para manter suas moléculas em ordem; especialmente se o grupo CH3 que ramifica a cadeia principal impede um melhor contato entre as moléculas.
Propriedades
Aparência física
Líquido incolor.
Cheirar e provar
Exala um odor desagradável de pêra e tem um sabor pungente.
Massa molar
88,148 g / mol.
Densidade
0,8104 g / mL a 20 ° C Portanto, é menos denso que a água.
Densidade do vapor
É 3,04 vezes mais denso que o ar.
Pressão de vapor
2,37 mmHg a 25 ° C.
Ponto de ebulição
131,1 ° C.
Ponto de fusão
-117,2 ° C.
ponto de ignição
43 ° C (copo fechado).
Temperatura de autoignição
340 ° C.
Solubilidade
É relativamente solúvel em água: 28g / L. Isso ocorre porque as moléculas altamente polares na água não têm uma afinidade especial para a cadeia de carbono do álcool isoamílico. Se fossem misturados, seriam observadas duas fases: uma inferior, correspondente à água, e outra superior, do álcool isoamílico..
Em contraste, é muito mais solúvel em solventes menos polares, como: acetona, éter dietílico, clorofórmio, etanol ou ácido acético glacial; e até mesmo em éter de petróleo.
Viscosidade
3.738 cP a 25 ° C.
Tensão superficial
24,77 dinas / cm a 15 ° C.
Índice de refração
1,4075 a 20 ° C.
Capacidade de calor
2.382 kJ / gK.
Formulários
Matéria prima
Outros ésteres, tiofeno e drogas como nitrito de amila, Validol (isovalerato de mentila), Bromisoval (bromovalerilureia), Corvalol (um tranqüilizante de valeriana) e Barbamil (amobarbital) podem ser sintetizados a partir do álcool isoamílico..
Fragrâncias
Além de ser usado para a síntese do acetato de amila, que tem aroma de banana, outras fragrâncias de frutas como damasco, laranja, ameixa, cereja e malte também são obtidas a partir dele. Portanto, é um álcool necessário na produção de muitos produtos comestíveis ou cosméticos..
Desespumante
Ao reduzir a tensão superficial, promove seu uso em sistemas microemulsificados. Praticamente, evita a formação acelerada de bolhas, reduzindo-as de tamanho até que se rompam.
Também ajuda a definir melhor a interface entre as fases aquosa e orgânica durante as extrações; por exemplo, fenol-clorofórmio é adicionado à mistura de extração em uma proporção de 25: 24: 1. Esta técnica é destinada à extração de DNA.
Extrações
O álcool isoamílico também permite extrair gorduras ou óleos de diferentes amostras, por exemplo do leite. Da mesma forma, ele dissolve a cera de parafina, tintas, gomas, lacas e ésteres de celulose.
Dando continuidade às extrações, é possível obter ácido fosfórico a partir de soluções de nitrato de minerais de fosfato de ferro..
Riscos
Armazenamento e reatividade
Como qualquer líquido que exala odores, pode representar um risco iminente de incêndio se o local onde está armazenado aumentar muito sua temperatura, ainda mais se já houver uma fonte de calor.
Nessas condições, ele simplesmente age como combustível, alimentando as chamas e até explodindo seu recipiente. Ao queimar, ele libera vapores que podem afetar a saúde e causar asfixia.
Outras causas que fazem o álcool isoamílico pegar fogo é misturá-lo ou fazê-lo reagir com substâncias como: percloratos, peróxidos, bromo, flúor, hidretos metálicos, ácidos fortes, aminas alifáticas, etc..
Saúde
Em contato com a pele, pode irritar e ressecar. Os sintomas, no entanto, são mais graves se inalados por muito tempo (tosse, queimaduras no nariz, garganta e pulmões) ou se ingeridos (dor de cabeça, náusea, diarreia, vômito, tontura e perda de consciência).
E, finalmente, quando atinge os olhos, irrita-os e pode até danificá-los de forma irreversível. Felizmente, seu cheiro de "pêra alcoólica" permite que seja detectado em caso de vazamento ou derramamento; além disso, é um composto que deve ser tratado com respeito.
Referências
- Morrison, R. T. e Boyd, R, N. (1987). Quimica Organica. 5ª Edição. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10ª edição). Wiley plus.
- Wikipedia. (2019). Álcool isoamílico. Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Álcool isoamílico. Banco de dados PubChem. CID = 31260. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Zhang Yu e Muhammed Mamoun. (17 de setembro de 2008). Extração de ácido fosfórico de soluções de nitrato com álcool isoamílico. Solvent Extraction and Ion Exchange Volume 6, 1988 - Issue 6. doi.org/10.1080/07366298808917973
- Departamento de Saúde de Nova Jersey. (2008). Álcool isoamílico. [PDF]. Recuperado de: nj.gov
- Kat Chem. (2019). Álcool isoamílico. Recuperado de: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Álcool isoamílico. Recuperado de: chemoxy.com

Ainda sem comentários