
Estrutura, propriedades, usos, produção do bissulfito de sódio (NaHSO3)

O bissulfito de sódio é um sólido inorgânico formado por um íon sódio Na+ e um íon bissulfito HSO3-. Sua fórmula química é NaHSO3. É um sólido cristalino branco e devido às suas propriedades antioxidantes é amplamente utilizado como conservante de alimentos (por exemplo, em algumas compotas).
O NaHSO3 é um composto químico redutor, que é o oposto do oxidante, por isso atua como antioxidante em muitas de suas aplicações, como em produtos comestíveis, pois evita sua deterioração.

No entanto, esse uso foi questionado, pois casos de asma foram relatados em pessoas após a ingestão de alimentos que contêm bissulfito de sódio. Diz-se mesmo que destrói a vitamina B1 nestes.
Organizações internacionais de saúde restringiram seu uso a micro-quantidades em alimentos.
No entanto, o bissulfito de sódio tem muitos outros usos, como na obtenção de iodo, como anti-infeccioso, para branquear tecidos, para a digestão de madeira durante a preparação da polpa de papel, como desinfetante para barris de cerveja e vinho, etc..
Índice do artigo
- 1 Estrutura química
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3,6 pH
- 3.7 Propriedades químicas
- 3.8 Riscos
- 4 Obtendo
- 5 usos
- 5.1 Na indústria de celulose e papel
- 5.2 Na indústria de alimentos
- 5.3 Controvérsia sobre seu uso na alimentação
- 5.4 Em aplicações agrícolas
- 5.5 Na obtenção de iodo
- 5.6 Na indústria moveleira e madeireira
- 5.7 Em várias aplicações
- 6 referências
Estrutura química
O bissulfito de sódio é composto por um cátion sódio Na+ e um ânion bissulfito HSO3-.
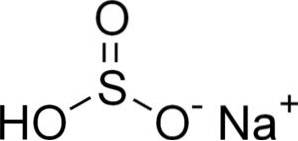
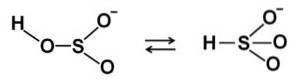
Em soluções aquosas, o bissulfito forma 4 espécies. Em solução diluída, há um equilíbrio entre as estruturas mostradas abaixo:
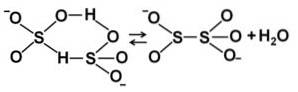
Quando a concentração aumenta, duas moléculas de bissulfito interagem entre si, formando o íon pirossulfito SdoisOU5dois-:
Nomenclatura
-Bissulfito de sódio
-Hidrogenossulfito de sódio
-Hidrossulfito de sódio.
Propriedades
Estado físico
Sólido branco cristalino.
Peso molecular
104,06 g / mol
Ponto de fusão
Se decompõe.
Densidade
1,48 g / cm3 a 20 ºC.
Solubilidade
Solúvel em água: 29 g / 100 g de água.
pH
Suas soluções são ácidas, com pH entre 2,5 e 5,5.
Propriedades quimicas
Em solução aquosa de bissulfito de sódio NaHSO3 se separa em seus íons: o cátion sódio Na+ e o ânion bissulfito HSO3-.
Se o bissulfito de sódio for exposto ao ar, ele perde algum SOdois e oxida lentamente em sulfato de NadoisSW4.
Se aquecido até a decomposição, ele emite vapores de óxidos de enxofre e monóxido de sódio..
É um agente redutor, que é o oposto do oxidante. E por isso pode se comportar como um antioxidante.
Tem um leve cheiro de enxofre. Não é inflamável.
Riscos
Bissulfito de sódio NaHSO3 é um forte irritante para a pele e os tecidos. A poeira irrita os olhos, nariz e garganta. Se ingerido, irrita o estômago. Grandes doses podem causar cólicas violentas, diarreia, depressão e morte..
Não é combustível, mas se aquecido produz gases irritantes e tóxicos.
Obtendo
É preparado saturando uma solução de carbonato de sódio NadoisCO3 com dióxido de enxofre SOdois e cristaliza em solução.
Formulários
Na indústria de celulose e papel
O NaHSO3 É utilizado na digestão da madeira, para que posteriormente se transforme em papel. Também serve como branqueador de polpa.
Também é usado para remover o cloro quando a polpa de papel foi branqueada com ele..
Na industria alimentícia
O bissulfito de sódio, por sua propriedade redutora, atua como antioxidante.
É usado como conservante em um grande número de alimentos e bebidas, incluindo vinho e cerveja, para prevenir a deterioração e melhorar o sabor.
É usado para branquear alimentos, como certos amidos comestíveis.
Reduz ou previne a deterioração dos alimentos, permite o condicionamento da massa utilizada na panificação e serve para amolecer os grãos de milho durante a moagem úmida, entre outros usos.
Além de controlar a fermentação do vinho e da cerveja, atua como anti-séptico na sua preparação, pois serve como esterilizador e fungicida em barricas e cubas..

Em frutas secas encontra-se em concentrações acima de 100 ppm (ppm significa "partes por milhão"), em muitos outros alimentos é encontrado em concentrações entre 10 e 100 ppm, como batatas congeladas e secas, pickles, molhos e compotas.

Polêmica sobre seu uso em alimentos
Tem havido alguma preocupação sobre os efeitos tóxicos imediatos e de longo prazo do bissulfito de sódio nos alimentos. Existem opiniões divergentes.
Há relatos de reações adversas em pacientes com asma, que é uma doença respiratória, após ingestão de alimentos com NaHSO3. Outras fontes indicam que o íon bissulfito pode destruir a vitamina B1 ou a tiamina.

No entanto, certos pesquisadores em 1985 descobriram que o bissulfito de sódio serve para proteger contra radiação e agentes químicos e inibe ou impede a transformação de células em câncer. Doses baixas são as melhores.
Este efeito protetor foi explicado com base em suas propriedades redutoras ou antioxidantes e que desta forma poderia atacar os radicais livres..
Por outro lado, a Organização Mundial da Saúde, ou OMS (por sua sigla em Inglês Organização Mundial da Saúde), recomenda como um nível aceitável de ingestão diária cerca de 0,7 mg / Kg de peso da pessoa.
Isso significa que é recomendável não exceder esse montante..
A Food and Drug Administration dos Estados Unidos, ou USFDA. US Food and Drug Administration), classificou o bissulfito de sódio como "geralmente reconhecido como seguro".
Em aplicações agrícolas
NaHSO usado em baixas concentrações3 serve como um regulador do crescimento da planta, para melhorar a fotossíntese e promover o rendimento da colheita.
Foi testado para este fim em vários tipos de plantas, como o morango e o chá..

É o ingrediente ativo em muitos pesticidas e biocidas.
Em ambientes aquáticos, também pode acelerar a transformação de certos herbicidas em produtos menos tóxicos, eliminando o cloro..
Na obtenção de iodo
O NaHSO3 é o composto redutor usado para liberar iodo do iodato de sódio NaIO3. Esta é uma das formas de obter iodo de fontes como o nitro do Chile ou algumas águas salinas.
Depois de cristalizar o nitrato de sódio da solução bruta de nitrato do Chile, uma solução de NaIO permanece3 que é tratado com bissulfito de sódio NaHSO3, gerando iodo livre.
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + N / DdoisSW4 + eudois
Na indústria moveleira e madeireira
O NaHSO3 Foi testado para modificar proteínas de soja e melhorar suas propriedades de adesão com madeira para colar pedaços de madeira para preparar, por exemplo, aglomerado, papelão ou papel machê, madeira compensada, etc. Tudo isso para móveis ou placas, entre diversas aplicações.

Isso é feito para substituir os adesivos tradicionais à base de formaldeído, porque tanto em seu processo de fabricação quanto durante seu uso, eles tendem a liberar formaldeído na atmosfera, que é um composto tóxico..
O Bissulfito de Sódio melhora o teor de sólidos do adesivo de proteína de soja e diminui sua viscosidade, melhorando sua fluidez para que penetre melhor nos poros da madeira, aumentando sua coesão com ela e entre as peças..
O adesivo de proteína de soja modificada por NaHSO3 tem boa resistência à água e excelente estabilidade de armazenamento devido à ação antioxidante do bissulfito de sódio.
Isso confirma que os adesivos de proteína de soja modificados com NaHSO3 são comparáveis aos adesivos à base de formaldeído e podem ser utilizados na indústria moveleira e madeireira, sendo menos poluentes.
Em várias aplicações
Tem múltiplas utilizações, geralmente baseadas nas suas propriedades redutoras (que é o oposto do oxidante). Aqui estão alguns aplicativos.
-Na fotografia.
-No curtimento de couro, para tirar os pelos das peles.
-Usos terapêuticos: anti-infeccioso. É usado como antioxidante em alguns colírios.
-Na extração de gás natural por fraturamento hidráulico.
-Na coloração de fibras é utilizado para a preparação de banheiras quentes ou frias, para solubilizar certos corantes ou corantes.
-Como redutor em lavanderia ou branqueamento, para branquear lã, seda e fibras vegetais.
-Em laboratórios de química, para remover manchas de permanganato da pele e roupas. Em laboratórios de bioquímica como conservante para líquidos ou soluções que podem se deteriorar com o tempo. Como um reagente químico.
-Para a coagulação de látex de borracha.
-Na indústria cosmética como antioxidante.
-Desinfetante e alvejante.
-No tratamento de efluentes para eliminação do cloro utilizado na etapa final da desinfecção e lançamento da água já tratada no meio ambiente.

Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Bissulfito de sódio. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Qi, G. et al. (2013). Adesão e propriedades físico-químicas da proteína de soja modificada pelo bissulfito de sódio. J Am Oil Chem Soc (2013) 90: 1917-1926. Recuperado de aocs.onlinelibrary.wiley.com.
- Borek, C. et al. (1985). O bissulfito de sódio protege contra a transformação radiogênica e quimicamente induzida em embriões de hamster e células C3H / 10T-1/2 de camundongo. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Recuperado de journals.sagepub.com.
- Friedler, E. et al. (2015). Uma abordagem de monitoramento ativo contínuo para identificar conexões cruzadas entre os sistemas de distribuição de água potável e efluentes. Environ Monit Assess (2015) 187: 131. Recuperado de link.springer.com.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Programa de Água Limpa de Sunnyvale. (2019). Plano Diretor da Planta de Controle da Poluição da Água. Recuperado de sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Aditivos na alimentação dos espanhóis e a legislação que regulamenta sua autorização e uso. Vision Books. Recuperado de books.google.co.ve.



Ainda sem comentários