
Estrutura, propriedades e usos do brometo de sódio (NaBr)
O brometo de sódio é uma espécie química pertencente aos sais de origem inorgânica. Sua estrutura é composta pelo halogênio bromo e pelo elemento metálico sódio na proporção de 1: 1. A sua fórmula química é NaBr e encontra-se em estado sólido de agregação em condições normais de temperatura e pressão (25 ° C e 1 atm).
Normalmente pode ser visto como um pó branco, sendo considerado um composto do tipo cristalino que também apresenta comportamento higroscópico; ou seja, ele tem a capacidade de absorver umidade de seus arredores.

Da mesma forma, o brometo de sódio possui características físicas muito semelhantes a outro composto iônico do mesmo metal: o cloreto de sódio. Este cloreto é representado como NaCl, que é mais comumente conhecido como sal comum ou sal de cozinha..
Tem um grande número de utilizações em diferentes campos da ciência; Por exemplo, é utilizado na produção de vários tipos de medicamentos (sedativos, hipnóticos, anticonvulsivantes, entre outros), bem como em sínteses orgânicas e até mesmo em aplicações fotográficas..
Índice do artigo
- 1 Estrutura química
- 1.1 Síntese Química
- 2 propriedades
- 3 usos
- 4 referências
Estrutura química
Como mencionado anteriormente, o brometo de sódio ocorre na fase sólida e, como muitos outros sais de natureza inorgânica, possui uma conformação estrutural cristalina..
Esta molécula cristalina, composta por um bromo e um átomo de hidrogênio, tem uma conformação do tipo cúbica de face centrada, como os sais do tipo haleto do mesmo metal (NaI, NaF e NaCl).
Este arranjo molecular forma a base estrutural de muitos compostos, nos quais o ordenamento é realizado de forma que cada íon permaneça no centro de uma figura octaédrica, conforme mostrado na imagem a seguir..
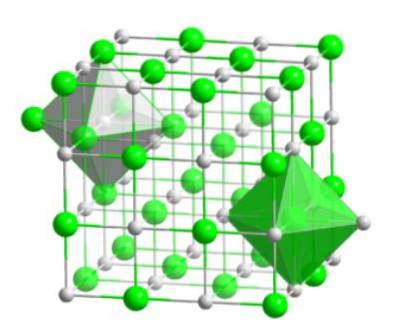
Nesse tipo de cristal pode-se observar como cada um dos íons possui ao seu redor seis outros íons - que possuem carga elétrica oposta - que estão localizados nas extremidades da figura octaédrica..
Da mesma forma, a estrutura desta substância iônica implica que ela possui um alto ponto de fusão de aproximadamente 747 ° C, sendo encontrada comercialmente em suas duas formas: uma espécie anidra (sem moléculas de água) e uma espécie diidratada (com duas moléculas de água em sua estrutura fórmula (NaBr 2HdoisO)), cujos pontos de fusão são diferentes.
Síntese química
O brometo de sódio tem origem na reação química que ocorre entre o brometo de hidrogênio (BrH, um haleto de hidrogênio na fase gasosa) e o hidróxido de sódio (NaOH, uma base forte na fase sólida e com propriedades higroscópicas).
Desta forma, é fabricado comercialmente, adicionando um excesso de bromo a uma solução de NaOH. Assim, é formada uma mistura de brometo / bromo. Posteriormente, os produtos resultantes são submetidos à evaporação até a secagem, e são tratados com carbono para gerar a reação de redução do íon bromato (BrO3-) para o íon brometo (Br-).
Neutralização
Da mesma forma, este sal inorgânico também pode ser produzido através de uma reação de neutralização de carbonato de sódio (NadoisCO3) com ácido brômico (HBrO3), seguindo o mesmo procedimento descrito acima.
Por meio de uma síntese, é possível produzir essa substância pela reação entre o ferro com o bromo e a água. Como um produto desta reação, a espécie de brometo ferroso-férrico se origina.
Mais tarde, esta espécie se formou (representada como FeBrdois/ FeBr3) é dissolvido em água e uma certa quantidade de carbonato de sódio é adicionada a ele. Por fim, a solução é filtrada e passa por um processo de evaporação para a obtenção do brometo de sódio..
Propriedades
- É comumente encontrado em um estado sólido de agregação, na forma de um pó branco.
- Possui estrutura cristalina, com arranjo molecular em forma de cubo centrado nas faces.
- O ponto de fusão dessa substância é de aproximadamente 747 ° C para a forma anidra e 36 ° C para a forma diidratada, apresentando decomposição antes da fusão..
- É composto por um íon de sódio (Na+) e um íon brometo (Br-), com uma massa molar ou peso molecular de 102,89 g / mol.
- Seu ponto de ebulição é bastante alto, observado a 1390 ° C (equivalente a 2530 ° F ou 1660 K).
- A solubilidade dessa espécie é em torno de 94,32 g / 100ml em água a 25 ° C, aumentando com o aumento da temperatura..
- Quando aquecida a ponto de se decompor, essa substância libera gases bromo e óxido de sódio, considerados tóxicos..
- A densidade da forma anidra do brometo de sódio é de 3,21 g / cm3, enquanto que o do composto di-hidratado é 2,18 g / cm3.
- Sua solubilidade em álcool é considerada moderada, como em outros solventes como piridina, amônia e hidrazina.
- Apresenta insolubilidade contra acetonitrila e acetona.
Formulários
- Na medicina, é usado como medicamento para um grande número de condições que causam convulsões e como terapia para prevenir a epilepsia em pacientes com síndrome de Wolf-Hirschhorn, bem como em tratamentos sedativos e hipnóticos..
- Na medicina veterinária, é usado em cães com distúrbios convulsivos devido aos efeitos colaterais de medicamentos como a primidona ou o fenobarbital.
- No campo da indústria do petróleo, é usado nos processos de preparação de certos fluidos de densidade variada que são usados em poços de petróleo..
- Na área de pesquisa biológica, suas propriedades microbicidas foram comprovadas; ou seja, é usado para controlar o desenvolvimento de diferentes tipos de bactérias.
- Em certas sínteses de tipo orgânico, este sal inorgânico é usado para a preparação de outras espécies que consistem em bromo. Por exemplo, por meio da reação de Finkelstein, certos halogenetos de alquila de alta reatividade são obtidos, um dos quais costumava ser amplamente utilizado em fotografia..
- Na área de limpeza e desinfecção, o brometo de sódio é utilizado em combinação com o cloro para a higienização de grandes volumes de água, como em piscinas e banheiras de hidromassagem..
Referências
- Wikipedia. (s.f.). Brometo de sódio. Recuperado de en.wikipedia.org
- PubChem. (s.f.). Brometo de sódio. Obtido em pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Convite para Química Orgânica. Recuperado de books.google.co.ve
- Science Direct. (s.f.). Brometo de sódio. Obtido em sciencedirect.com
- Riviere, J. E. e Papich, M. G. (2009). Farmacologia e Terapêutica Veterinária. Recuperado de books.google.co.ve


Ainda sem comentários