
Calor dadas fórmulas, como calculá-lo e exercícios resolvidos
O calor produzido é a transferência de energia entre dois corpos em temperaturas diferentes. Aquele com a temperatura mais alta cede o calor para aquele cuja temperatura é mais baixa. Quer um corpo ceda ou absorva calor, sua temperatura ou seu estado físico podem variar dependendo da massa e das características do material do qual é feito..
Um bom exemplo é uma xícara de café fumegante. A colher de metal com a qual o açúcar é mexido aquece. Se ficar na xícara por tempo suficiente, o café e uma colher de metal acabam igualando suas temperaturas: o café terá esfriado e a colher terá esquentado. Algum calor terá passado para o ambiente, uma vez que o sistema não é isolado.

À medida que as temperaturas se igualaram, o Equilíbrio térmico.
Se você fizesse o mesmo teste com uma colher de chá de plástico, certamente notaria que ela não aquece tão rapidamente quanto a de metal, mas eventualmente também entrará em equilíbrio com o café e tudo ao seu redor..
Isso ocorre porque o metal conduz o calor melhor do que o plástico. Por outro lado, certamente o café produz calor em uma taxa diferente do chocolate quente ou outra bebida. Portanto, o calor fornecido ou absorvido por cada objeto depende do material ou substância de que ele é feito..
Índice do artigo
- 1 Em que consiste e fórmulas
- 1.1 A diferença de temperatura ΔT
- 1.2 Calor específico e capacidade de calor de uma substância
- 2 Como calcular?
- 2.1 Calorimetria
- 3 exercícios resolvidos
- 3.1 Exercício 1
- 3.2 Exercício 2
- 4 referências
Em que consiste e fórmulas
O calor sempre se refere ao fluxo ou trânsito de energia entre um objeto e outro, devido à diferença de temperatura.
É por isso que falamos de calor transferido ou calor absorvido, pois ao adicionar ou extrair calor ou energia de alguma forma, é possível modificar a temperatura de um elemento..
A quantidade de calor que o objeto mais quente emite é geralmente chamada de Q. Este valor é proporcional à massa do referido objeto. Um corpo com uma grande massa é capaz de produzir mais calor do que outro com uma massa menor..
Diferença de temperatura ΔT
Outro fator importante no cálculo do calor liberado é a diferença de temperatura experimentada pelo objeto que libera o calor. É denotado como ΔT e é calculado assim:
ΔT = TF - Tou
Por fim, a quantidade de calor transferida também depende da natureza e das características do objeto, que se resumem quantitativamente em uma constante chamada calor específico do material, denotado como c.
Então, finalmente, a expressão para o calor transferido é a seguinte:
Qrendeu = - m.c.ΔT
Ceder é simbolizado por um sinal negativo.
Calor específico e capacidade de calor de uma substância
Calor específico é a quantidade de calor necessária para elevar em 1 ºC a temperatura de 1 g da substância. É uma propriedade intrínseca do material. Suas unidades no Sistema Internacional são: Joule / kg. K (Joule entre quilograma x temperatura em graus Kelvin).
A capacidade térmica C é um conceito interligado, mas ligeiramente diferente, uma vez que a massa do objeto está envolvida. A capacidade de calor é definida como segue:
C = mc
Suas unidades em S.I. eles são Joule / K. Portanto, o calor liberado também pode ser expresso de forma equivalente como:
Q = -C. ΔT
Como calcular?
Para calcular o calor emitido por um objeto, é necessário saber o seguinte:
- O calor específico da substância que libera o calor.
- A massa da referida substância
- A temperatura final para obter
Os valores de calor específicos para muitos materiais foram determinados experimentalmente e estão disponíveis nas tabelas.
Calorimetria
Agora, se esse valor não for conhecido, é possível obtê-lo com o auxílio de um termômetro e água em um recipiente termicamente isolado: o calorímetro. Um diagrama deste dispositivo é mostrado na figura que acompanha o exercício 1.
Uma amostra da substância em uma determinada temperatura é imersa em uma quantidade de água previamente medida. A temperatura final é medida e o calor específico do material é determinado com os valores obtidos..
Ao comparar o resultado com os valores tabulados, pode-se saber de que substância se trata. Este procedimento é chamado calorimetria.
O equilíbrio térmico é realizado pela conservação de energia:
Q rendeu + Q absorvido = 0
Exercícios resolvidos
Exercício 1
Um pedaço de cobre de 0,35 kg é introduzido a uma temperatura de 150ºC em 500 mL de água a uma temperatura de 25ºC. Encontre:
a) A temperatura final de equilíbrio
b) Quanto calor flui neste processo?
Dados
ccobre = 385 J / kg. ºC
cágua = 4180 J / kg. ºC
Densidade da água: 1000 kg / m3
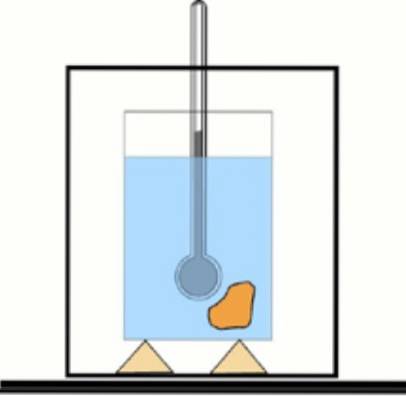
Solução
a) O cobre libera o calor enquanto a água o absorve. Como o sistema é considerado fechado, apenas a água e a amostra intervêm no balanço térmico:
Q rendeu = Q absorvido
Por outro lado, é necessário calcular a massa de 500 mL de água:
500 mL = 0,5 L = 0,0005 m3
Com esses dados, a massa da água é calculada:
massa = densidade x volume = 1000 kg / m3 . 0,0005 m3 = 0,5 kg
A equação para o calor em cada substância é levantada:
Qrendeu = -mcobre . ccobre. ΔT = -0,35 kg. 385 J / kg. ° C . (TF -150 ºC) = -134,75 (TF - 150) J
Qabsorvido = mÁgua . cÁgua. ΔT = 0,5 kg. 4186 J / kg. ºC. (TF -25 ºC) = 2093 (TF -25) J
Equacionando os resultados, temos:
2093 (TF - 25) = -134,75 (TF - 150)
É uma equação linear com uma incógnita, cuja solução é:
TF = 32,56 ºC
b) A quantidade de calor que flui é o calor transferido ou o calor absorvido:
Q rendeu = - 134,75 (32,56 - 150) J = 15823 J
Q absorvido = 2093 (32,56 - 25) J = 15823 J
Exercício 2
Um pedaço de 100 g de cobre é aquecido em um forno a uma temperatura Tou e então é introduzido em um calorímetro de cobre 150 g contendo 200 g de água a 16ºC. A temperatura final uma vez em equilíbrio é de 38ºC. Quando o calorímetro e seu conteúdo são pesados, verifica-se que eles evaporaram 1,2 g de água. a temperatura inicial Tou?
Dados: o calor latente de vaporização da água é Lv = 2257 kJ / kg
Solução
Este exercício difere do anterior, pois deve-se considerar que o calorímetro também absorve calor. O calor liberado pelo pedaço de cobre é investido em todos os seguintes:
- Aqueça a água no calorímetro (200 g)
- Aqueça o cobre do qual o calorímetro é feito (150 g)
- Evapore 1,2 gramas de água (energia também é necessária para uma mudança de fase).
Qrendeu = -100 x 1 x 10 -3 kg. 385 J / kg. ºC. (38 - Tou ) ºC = -38,5. (38 - Tou) J
Q absorvido por calorímetro = Q absorvido pela água + Q vaporização + Q absorvido por cobre
0,2 kg .4186 J / kg ºC. (38 - 16 ºC) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg .385 J / kg .ºC. (38 - 16 ºC) =
18418,4 +2708,4 + 1270,5 J = 22397,3 J
Portanto:
-38,5. (38 - Tou) = 22397,3
Tou = 619,7 ºC
O calor necessário para levar 1,2 g de água até 100ºC também poderia ter sido considerado, mas é uma quantidade bem pequena em comparação..
Referências
- Giancoli, D. 2006. Física: Princípios com Aplicações. 6º. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Physics: A Look at the World. 6ta Edição reduzida. Cengage Learning. 156 - 164.
- Rex, A. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Física Universitária com Física Moderna. 14º. Ed. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9n / D Cengage Learning.



Ainda sem comentários