
Calor latente

O que é calor latente?
Calor latente é a quantidade de calor que uma substância precisa absorver ou liberar para mudar seu estado físico ou fase, mantendo a temperatura constante durante esse processo. O calor fornecido ou liberado não se manifesta, não se "sente" como é normal em uma variação de temperatura; daí o termo calor latente.
A palavra latente vem da palavra latina "latens", que significa oculto, então o calor latente se comporta como se não existisse quando a temperatura era mantida constante. Mas existe: o que acontece é que é totalmente consumido na mudança de fase ou estado físico.
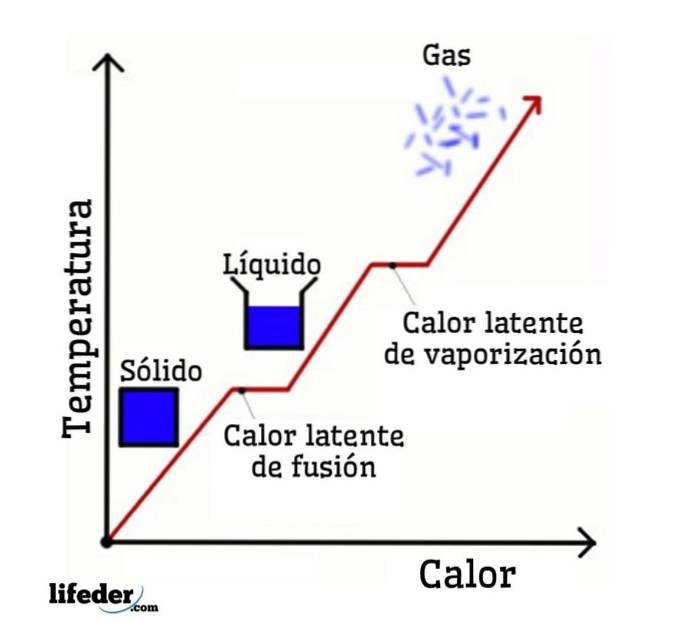
Tomando a água como exemplo, as mudanças de fase são as seguintes: gelo (sólido) derrete em água líquida (líquida) em um processo chamado derretimento; e a água líquida, por sua vez, vaporiza para se transformar em vapor de água (gás) em um processo denominado vaporização.
Por outro lado, o vapor de água é resfriado a água líquida em um processo denominado condensação; e a água líquida se transforma em gelo em um processo chamado de solidificação.
Cada uma dessas mudanças de fase está associada a um calor latente, que pode ser positivo (absorção) ou negativo (liberação)..
Calor de fusão latente

É a quantidade de calor que deve ser fornecida a uma determinada quantidade de substância sólida para mudar seu estado físico de sólido para líquido. Durante a fusão não há mudança de temperatura, então enquanto o sólido derrete ou derrete o líquido que é gerado a partir dele tem a mesma temperatura que o sólido inteiro.
Geralmente, esse calor é determinado no ponto de fusão normal, que é a temperatura na qual o sólido começa a derreter sob a pressão atmosférica. A esta temperatura existe um equilíbrio ou presença simultânea do estado sólido e do estado líquido ao mesmo tempo..
O estado sólido é caracterizado pela presença de uma estrutura compacta devido à existência de ligações químicas de alta energia, que lhe conferem rigidez estrutural. Para a transformação de um sólido em líquido, essas interações devem ser quebradas, de forma que a energia seja consumida (absorvida) para esse fim.
Um exemplo típico é quando se consome um sorvete, à base de água, açúcar e outras substâncias. É comum observar que o sorvete, se não for consumido rapidamente, começa a derreter, ou seja, a derreter. Isso ocorre quando a temperatura do sorvete atinge o ponto de derretimento do gelo..
Exemplos
Alguns exemplos de calores latentes de fusão expressos em J / g serão listados; ou seja, a energia que um grama de sólido deve absorver para derreter no ponto de fusão:
-Gelo 334,0
-Alumínio 380,0
-Enxofre 38,1
-Cobre 134,0
-Etanol 104,0
-Mercúrio 11,8
-Ouro 64,5
-Silver 80,3
-Lead 24,5
-Tungstênio 184
O gelo absorve muito calor não porque suas interações sejam mais fortes, mas porque é capaz de dissipar excepcionalmente o calor entre seus cristais..
Calor latente de vaporização
É a quantidade de calor que uma determinada quantidade de substância absorve para passar do estado líquido para o estado gasoso no ponto de ebulição normal. Ou seja, é o calor que o líquido absorve ao ferver e se transforma em gás sem aumento de temperatura..
No líquido, as moléculas das substâncias podem interagir pela formação de ligações de hidrogênio e por forças de atração entre as moléculas. Para passar uma substância do estado líquido para o estado gasoso, essas forças devem ser superadas, portanto, o calor deve ser fornecido.
Calor sensível é o que o líquido absorve apenas para aumentar sua temperatura, que dependerá de seu calor específico. Enquanto isso, o calor latente da vaporização é usado para transformá-lo diretamente em vapor, processo que é muito mais fácil no ponto de ebulição..
Exemplos
Listados abaixo estão exemplos de alguns líquidos com seus respectivos calores latentes de vaporização novamente expressos em J / g:
-Ácido acético 402
-Acetona 518
-Água 2256
-Álcool etílico 846
-Enxofre 1510
-Benzeno 390
-Dióxido de carbono 574
-Cloro 293
-Ether 377
-Glicerina 974
-Mercury 295
-Oxigênio 214
Observe o enorme calor latente da água líquida: 1 g de água líquida (cerca de 1 mL) precisa absorver 2256 J para vaporizar. A água líquida dissipa o calor que recebe ainda melhor em comparação com o gelo.
Calor latente de solidificação
É o calor que uma certa quantidade de substância deve liberar para passar do estado líquido ao sólido, no ponto de solidificação ou congelamento. Novamente, até que o líquido tenha solidificado completamente, a temperatura permanecerá constante..
O processo de solidificação é o inverso do processo de fusão, portanto os valores do calor latente de solidificação e do calor latente de fusão são os mesmos, mas com sinais opostos..
As moléculas de uma substância no estado líquido movem-se com certa liberdade devido à energia que possuem. Portanto, para passar à fase sólida, as moléculas devem liberar energia na forma de calor, o que permite maior interação entre as moléculas da substância..
A interação entre as moléculas favorece a formação das ligações químicas da fase sólida. Um exemplo disso ocorre quando a água líquida é colocada nos recipientes de formação de gelo no freezer da geladeira. O freezer extrai calor da água líquida e ela se solidifica para se tornar gelo.
Exemplos
Alguns exemplos de calores latentes de solidificação (em J / g) para alguns líquidos estão listados abaixo:
-Água (-334)
-Alumínio (-380)
-Enxofre (-38)
-Cobre (-134)
-Etanol (-104)
Calor latente de condensação
É a quantidade de calor que deve ser desprendida ou liberada de uma determinada quantidade de substância, para passar do estado gasoso ao líquido. O gás que condensa e o líquido formado mantêm a mesma temperatura durante a condensação.
A condensação é o oposto da vaporização. O calor latente de condensação tem o mesmo valor que o calor latente de vaporização, mas com sinal oposto e no ponto de ebulição. Um exemplo disso é quando se cozinha e se condensa o vapor no interior das panelas..
As moléculas gasosas se movem livremente movidas pela energia que possuem. Portanto, eles devem liberar energia para permitir que as interações intermoleculares do estado líquido se estabeleçam entre as moléculas da substância..
Na natureza, existem muitos outros exemplos do fenômeno da condensação da água. O vapor d'água sobe na atmosfera e se condensa nas nuvens na forma de gotículas de água.
Observa-se também a presença de gotículas de água nas janelas dos carros, em decorrência da condensação da água devido a uma queda de temperatura que ocorre no início da manhã, constituindo o chamado orvalho..
Exemplos
Por fim, para alguns vapores serão listados seus respectivos calores latentes de condensação expressos, mais uma vez, em J / g:
-Ácido acético (-402)
-Acetona (-518)
-Água (-2256)
-Álcool etílico (-846)
-Enxofre (-1510)
-Benzeno (-390)
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Química Física. Em cinética química. Quarta edição, Longmans.
- Wikipedia. (2020). Calor latente. Recuperado de: en.wikipedia.org
- Os editores da Encyclopaedia Britannica. (2020). Calor latente. Recuperado de: britannica.com
- Caixa de ferramentas de engenharia. (2003). Fluidos: calor latente de evaporação. Recuperado de: engineeringtoolbox.com
- Lumen Learning. (s.f.). Mudança de fase e calor latente. Recuperado de :ourses.lumenlearning.com


Ainda sem comentários