
Conceito de sensibilidade ao calor, fórmulas e exercícios resolvidos
O calor sensível é a energia térmica fornecida a um objeto fazendo com que ele aumente sua temperatura. É o oposto do calor latente, em que a energia térmica não aumenta a temperatura, mas promove uma mudança de fase, por exemplo, de sólido para líquido..
Um exemplo esclarece o conceito. Suponha que temos um pote de água a uma temperatura ambiente de 20 ° C. Quando o colocamos no fogão, o calor fornecido aumenta a temperatura da água lentamente até atingir 100 ° C (temperatura de ebulição da água ao nível do mar). O calor fornecido é chamado de calor sensível.

Quando a água atinge o ponto de ebulição, o calor fornecido pelo queimador não eleva mais a temperatura da água, que permanece em 100 ° C. Neste caso, a energia térmica fornecida é investida na evaporação da água. O calor fornecido é latente porque não elevou a temperatura, mas, em vez disso, causou uma mudança da fase líquida para a fase gasosa.
É um fato experimental que o calor sensível necessário para atingir uma certa variação de temperatura é diretamente proporcional a essa variação e à massa do objeto..
Índice do artigo
- 1 Conceito e fórmulas
- 1.1 O coeficiente adiabático γ
- 1.2 Capacidade de calor C
- 1.3 Calor específico em sólidos, líquidos e gases
- 2 Diferença com calor latente
- 2.1 Como calcular o calor latente?
- 3 exercícios resolvidos
- 3.1 Exemplo 1
- 3.2 Exemplo 2
- 3.3 Exemplo 3
- 4 referências
Conceito e fórmulas
Observou-se que além da massa e da diferença de temperatura, o calor sensível também depende do material. Por este motivo, a constante de proporcionalidade entre o calor sensível e o produto da massa e a diferença de temperatura é chamada de calor específico.
A quantidade de calor sensível fornecido também depende de como o processo é realizado. Por exemplo, é diferente se o processo for realizado em volume constante do que em pressão constante.
A fórmula para calor sensível em um processo isobárico, ou seja, a pressão constante, é o seguinte:
Q = cp . m (TF - Teu)
Na equação acima Q é o calor sensível fornecido ao objeto de massa m, que aumentou sua temperatura inicial Teu até o valor final Tf. Na equação acima, também aparece cp, que é o calor específico do material a pressão constante porque o processo foi realizado desta forma.
Observe também que o calor sensível é positivo quando é absorvido pelo objeto e causa um aumento na temperatura..
No caso em que o calor é fornecido a um gás encerrado em um recipiente rígido, o processo será isocórico, ou seja, em volume constante; e a fórmula para o calor sensível será escrita assim:
Q = cv. m. (TF - Teu)
O coeficiente adiabático γ
O quociente entre o calor específico a pressão constante e o calor específico a volume constante para o mesmo material ou substância é denominado coeficiente adiabático, que geralmente é denotado pela letra grega gama γ.
O coeficiente adiabático é maior do que a unidade. O calor necessário para elevar a temperatura de um corpo de um grama de massa em um grau é maior em um processo isobárico do que em um isocórico..
Isso ocorre porque no primeiro caso parte do calor é usado para realizar trabalhos mecânicos.
Além do calor específico, a capacidade térmica de um corpo também é frequentemente definida. Esta é a quantidade de calor necessária para elevar a temperatura daquele corpo em um grau centígrado.
Capacidade calorífica C
A capacidade de calor é denotada por C letra maiúscula, enquanto o calor específico com c minúsculas. A relação entre as duas quantidades é:
C = c⋅ m
Onde m é a massa do corpo.
Calor específico molar também é usado, que é definido como a quantidade de calor sensível necessária para elevar a temperatura de um mol de substância em um grau Celsius ou Kelvin..
Calor específico em sólidos, líquidos e gases
O calor específico molar da maioria dos sólidos tem um valor próximo a 3 vezes R, Onde R é a constante universal de gás. R = 8,314472 J / (mol ℃).
Por exemplo, o alumínio tem calor específico molar 24,2 J / (mol ℃), o cobre 24,5 J / (mol ℃), o ouro 25,4 J / (mol ℃), e o ferro doce 25,1 J / (mol ℃). Observe que esses valores estão próximos de 3R = 24,9 J / (mol ℃).
Em contraste, para a maioria dos gases, o calor específico molar está próximo de n (R / 2), onde é n um inteiro e R é a constante universal do gás. O número inteiro n está relacionado ao número de graus de liberdade da molécula que compõe o gás.
Por exemplo, em um gás ideal monoatômico, cuja molécula tem apenas os três graus de liberdade de translação, o calor específico molar em volume constante é 3 (R / 2). Mas se for um gás ideal diatômico, existem adicionalmente dois graus de rotação, então cv = 5 (R / 2).
Em gases ideais, a seguinte relação entre o calor específico do molar a pressão constante e volume constante se mantém: cp = cv + R.
Menção especial merece a água. No estado líquido a 25 ℃, a água tem cp = 4,1813 J / (g ℃), vapor de água a 100 graus centígrados tem cp = 2.080 J / (g ℃) e água gelada a zero grau Celsius tem cp = 2.050 J / (g ℃).
Diferença com calor latente
A matéria pode estar em três estados: sólido, líquido e gasoso. A energia é necessária para mudar de estado, mas cada substância responde a ela de uma maneira diferente de acordo com suas características moleculares e atômicas..
Quando um sólido está derretendo ou um líquido está evaporando, a temperatura do objeto permanece constante até que todas as partículas tenham mudado de estado..
Por isso, é possível que uma substância esteja em equilíbrio em duas fases: sólido - líquido ou líquido - vapor, por exemplo. Uma quantidade da substância pode passar de um estado a outro adicionando ou removendo um pouco de calor, enquanto a temperatura permanece fixa..
O calor fornecido a um material faz com que suas partículas vibrem mais rápido e aumentem sua energia cinética. Isso se traduz em um aumento na temperatura.
É possível que a energia que adquirem seja tão grande que não retornem mais à posição de equilíbrio e aumente a separação entre eles. Quando isso acontece a temperatura não aumenta, mas a substância passa do sólido ao líquido ou do líquido ao gasoso.
O calor necessário para que isso aconteça é conhecido como calor latente. Portanto, o calor latente é o calor pelo qual uma substância pode mudar de fase.
Aqui está a diferença com o calor sensível. Uma substância que absorve calor sensível aumenta sua temperatura e permanece no mesmo estado.
Como calcular o calor latente?
O calor latente é calculado pela equação:
Q = m. eu
Onde eu pode ser o calor específico de vaporização ou o calor de fusão. As unidades de eu são energia / massa.
Os cientistas deram ao calor vários nomes, dependendo do tipo de reação da qual ele participa. Por exemplo, existe o calor de reação, o calor de combustão, o calor de solidificação, o calor de solução, o calor de sublimação e muitos outros..
Os valores de muitos desses tipos de calor para diferentes substâncias são tabulados.
Exercícios resolvidos
Exemplo 1
Suponha que a tenha um pedaço de alumínio com massa de 3 kg. Inicialmente está a 20 ° C e você deseja elevar sua temperatura para 100 ° C. Calcule o calor sensível necessário.
Solução
Primeiro, precisamos saber o calor específico do alumínio
cp = 0,897 J / (g ° C)
Então, a quantidade de calor necessária para aquecer a peça de alumínio será
Q = cp m (Tf - Ti) = 0,897 * 3000 * (100 - 20) J
Q = 215 280 J
Exemplo 2
Calcule a quantidade de calor necessária para aquecer 1 litro de água de 25 ° C a 100 ° C ao nível do mar. Expresse o resultado também em quilocalorias.
Solução
A primeira coisa a lembrar é que 1 litro de água pesa 1 kg, ou seja, 1000 gramas.
Q = cp m (Tf - Ti) = 4,1813 J / (g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
A caloria é uma unidade de energia definida como o calor sensível necessário para elevar um grama de água em um grau Celsius. Portanto, 1 caloria é igual a 4,1813 Joules.
Q = 313597,5 J * (1 cal / 4,1813 J) = 75000 cal = 75 kcal.
Exemplo 3
Um pedaço de material de 360,16 gramas é aquecido de 37 ℃ a 140 ℃. A energia térmica fornecida é 1150 calorias.
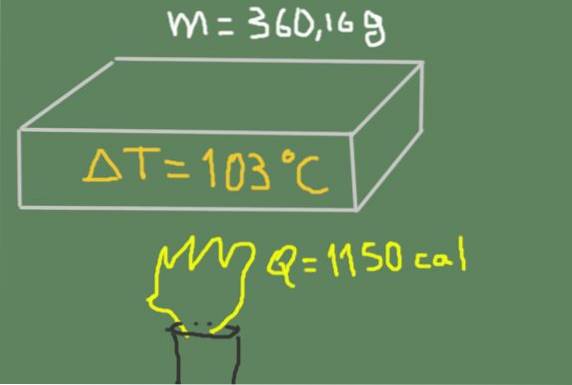
Encontre o calor específico do material.
Solução
Podemos escrever o calor específico em função do calor sensível, da massa e da variação da temperatura de acordo com a fórmula:
cp = Q / (m ΔT)
Substituindo os dados, temos o seguinte:
cp = 1150 cal / (360,16 g * (140 ℃ - 37 ℃)) = 0,0310 cal / (g ℃)
Mas, uma vez que uma caloria é igual a 4,1813 J, o resultado também pode ser expresso como
cp = 0,130 J / (g ℃)
Referências
- Giancoli, D. 2006. Física: Princípios com Aplicações. 6º. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Physics: A Look at the World. 6ta Edição reduzida. Cengage Learning. 156 - 164.
- Tippens, P. 2011. Physics: Concepts and Applications. 7º. Edição revisada. McGraw Hill. 350 - 368.
- Rex, A. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Física Universitária com Física Moderna. 14º. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9n / D Cengage Learning. 362 - 374.



Ainda sem comentários