
Calorimetria que estudos e aplicações
O calorimetria é uma técnica que determina as mudanças no conteúdo calórico de um sistema associado a um processo químico ou físico. Baseia-se na medição das mudanças de temperatura quando um sistema absorve ou emite calor. O calorímetro é o equipamento usado em reações nas quais uma troca de calor está envolvida.
O que é conhecido como "xícara de café" é a forma mais simples desse tipo de aparelho. Através da sua utilização, mede-se a quantidade de calor envolvida nas reações realizadas a pressão constante em solução aquosa. Um calorímetro de xícara de café consiste em um recipiente de poliestireno, que é colocado em um copo..

A água é colocada no recipiente de poliestireno, munido de uma tampa do mesmo material que lhe confere um certo grau de isolamento térmico. Além disso, o recipiente possui um termômetro e um agitador mecânico..
Este calorímetro mede a quantidade de calor que é absorvida ou emitida, dependendo se a reação é endotérmica ou exotérmica, quando uma reação ocorre em uma solução aquosa. O sistema a ser estudado é composto pelos reagentes e produtos.
Índice do artigo
- 1 O que a calorimetria estuda?
- 2 Capacidade de calor de um calorímetro
- 2.1 Exemplo de uso do calorímetro para calcular o calor específico
- 3 bomba calorimétrica
- 4 tipos de calorímetro
- 4.1 Calorímetro de titulação isotérmica (CTI)
- 4.2 Calorímetro Diferencial de Varredura
- 5 aplicativos
- 5.1 Usos de calorimetria de titulação isotérmica
- 5.2 Usos de Calorimetria de Varredura Diferencial
- 6 referências
O que a calorimetria estuda?
A calorimetria estuda a relação entre a energia térmica associada a uma reação química e como ela é usada para determinar suas variáveis. Suas aplicações em campos de pesquisa justificam o escopo desses métodos.
Capacidade calórica de um calorímetro
Esta capacidade é calculada dividindo a quantidade de calor absorvida pelo calorímetro pela mudança de temperatura. Essa variação é o produto do calor que é emitido em uma reação exotérmica, que é igual a:
Quantidade de calor absorvida pelo calorímetro + quantidade de calor absorvida pela solução
A variação pode ser determinada adicionando uma quantidade conhecida de calor medindo a mudança na temperatura. Para esta determinação da capacidade calórica, geralmente é utilizado o ácido benzóico, já que seu calor de combustão é conhecido (3.227 kJ / mol).
A capacidade calórica também pode ser determinada pela adição de calor por meio de uma corrente elétrica.
Exemplo de usar o calorímetro para calcular o calor específico
Uma barra de 95 g de um metal é aquecida a 400ºC, levando-se imediatamente a um calorímetro com 500 g de água, inicialmente a 20ºC. A temperatura final do sistema é de 24 ºC. Calcule o calor específico do metal.
Δq = m x ce x Δt
Nesta expressão:
Δq = variação de carga.
m = massa.
ce = calor específico.
Δt = variação de temperatura.
O calor ganho pela água é igual ao calor emitido pela barra de metal.
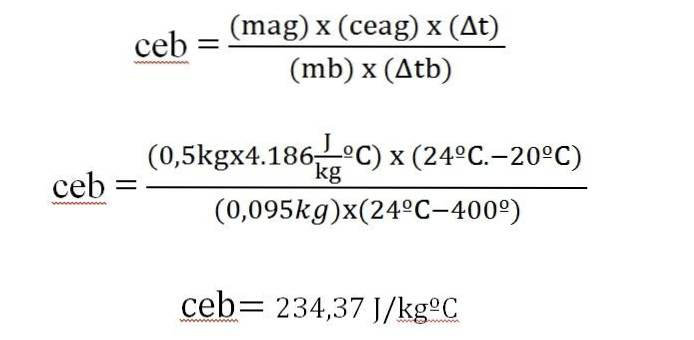
Este valor é semelhante ao que aparece em uma tabela do calor específico para prata (234 J / kg ºC).
Assim, uma das aplicações da calorimetria é a cooperação para a identificação de materiais..
Bomba calorimétrica
Consiste em um recipiente de aço, conhecido como bomba, resistente às altas pressões que podem surgir durante as reações que ocorrem neste recipiente; este recipiente é conectado a um circuito de ignição para iniciar as reações.
A bomba é imersa em um grande recipiente com água, cuja função é absorver o calor que é gerado na bomba durante as reações, tornando pequena a variação de temperatura. O recipiente de água é equipado com um termômetro e um agitador mecânico.
As mudanças de energia são medidas em volume e temperatura virtualmente constantes, então nenhum trabalho é feito nas reações que ocorrem na bomba.
ΔE = q
ΔE é a variação da energia interna na reação eq o calor gerado neste.
Tipos de calorímetro
Calorímetro de titulação isotérmica (CTI)
O calorímetro possui duas células: em uma é colocada a amostra e na outra, a de referência, geralmente a água é colocada.
A diferença de temperatura gerada entre as células - devido à reação que ocorre na célula de amostra - é cancelada por um sistema de feedback que injeta calor para equalizar as temperaturas das células..
Este tipo de calorímetro permite acompanhar a interação entre macromoléculas e seus ligantes..
Calorímetro diferencial de varredura
Este calorímetro possui duas células, como o CTI, mas possui um dispositivo que permite determinar a temperatura e os fluxos de calor associados às mudanças em um material em função do tempo.
Esta técnica fornece informações sobre o dobramento de proteínas e ácidos nucléicos, bem como sua estabilização..
Formulários

-A calorimetria permite determinar a troca de calor que ocorre em uma reação química, permitindo assim uma compreensão mais clara do mecanismo desta..
-Ao determinar o calor específico de um material, a calorimetria fornece dados que ajudam a identificá-lo.
-Como existe uma proporcionalidade direta entre a mudança de calor de uma reação e a concentração dos reagentes, aliada ao fato de a calorimetria não exigir amostras claras, essa técnica pode ser utilizada para determinar a concentração de substâncias presentes em matrizes complexas..
-No campo da engenharia química, a calorimetria é utilizada no processo de segurança, bem como em diferentes campos do processo de otimização, reação química e na unidade operacional..
Usos de calorimetria de titulação isotérmica
-Colabora no estabelecimento do mecanismo de ação enzimática, bem como na sua cinética. Esta técnica pode medir reações entre moléculas, determinando afinidade de ligação, estequiometria, entalpia e entropia em solução sem a necessidade de marcadores..
-Avalia a interação de nanopartículas com proteínas e, em conjunto com outros métodos analíticos, é uma ferramenta importante para registrar mudanças conformacionais em proteínas..
-Tem aplicação na conservação de alimentos e culturas.
-Em relação à preservação dos alimentos, é possível determinar sua deterioração e prazo de validade (atividade microbiológica). Pode comparar a eficiência de diferentes métodos de conservação de alimentos, e é capaz de determinar a dose ideal de conservantes, bem como a degradação no controle da embalagem..
-Quanto às hortaliças, você pode estudar a germinação da semente. Estando na água e na presença de oxigênio, eles liberam calor que pode ser medido com um calorímetro isotérmico. Examine a idade e o armazenamento inadequado das sementes e estude sua taxa de crescimento em face das variações de temperatura, pH ou diferentes produtos químicos.
-Finalmente, você pode medir a atividade biológica dos solos. Além disso, pode detectar doenças.
Usos da Calorimetria de Varredura Diferencial
-Junto com a calorimetria isotérmica, tornou possível estudar a interação de proteínas com seus ligantes, a interação alostérica, o enovelamento de proteínas e o mecanismo de sua estabilização..
-O calor que é liberado ou absorvido durante um evento de ligação molecular pode ser medido diretamente.
-A calorimetria de varredura diferencial é uma ferramenta termodinâmica para o estabelecimento direto da captação de energia térmica que ocorre em uma amostra. Isso permite analisar os fatores envolvidos na estabilidade da molécula da proteína..
-Ele também estuda a termodinâmica da transição de dobramento de ácido nucleico. A técnica permite a determinação da estabilidade oxidativa do ácido linoléico isolado e acoplado a outros lipídeos..
-A técnica é aplicada na quantificação de nanossólidos para uso farmacêutico e na caracterização térmica de transportadores lipídicos nanoestruturados..
Referências
- Whitten, K., Davis, R., Peck, M. e Stanley, G. Química. (2008). 8ª ed. Edição Cengage Learning.
- Rehak, N. N. e Young, D. S. (1978). Aplicações prospectivas de calorimetria no laboratório clínico. Clin. Chem. 24 (8): 1414-1419.
- Stossel, F. (1997). Aplicações da calorimetria de reação em engenharia química. J. Therm. Anal. 49 (3): 1677-1688.
- Weber, P. C. e Salemme, F. R. (2003). Aplicações de métodos calorimétricos para descoberta de drogas e o estudo de interações de proteínas. Curr. Opin. Struct. Biol. 13 (1): 115-121.
- Gill, P., Moghadem, T. e Ranjbar, B. (2010). Técnicas calorimétricas de varredura diferencial: aplicações em biologia e nanociência. J. Biol. Tech. 21 (4): 167-193.
- Omanovic-Miklicanin, E., Manfield, I. e Wilkins, T. (2017). Aplicações da calorimetria de titulação isotérmica na avaliação das interações proteína-nanopartícula. J. Therm. Anal. 127: 605-613.
- Consórcio de faculdades comunitárias para credenciais de biociências. (7 de julho de 2014). Calorímetro de xícara de café. [Figura]. Obtido em 7 de junho de 2018, em: commons.wikimedia.org



Ainda sem comentários