
História do calorímetro, peças, tipos e suas características
O calorímetro é um dispositivo usado para medir a mudança na temperatura de uma quantidade de substância (geralmente água) de calor específico conhecido. Essa mudança de temperatura se deve ao calor absorvido ou liberado no processo em estudo; químico se for uma reação, ou físico se consistir em uma mudança de fase ou estado.
No laboratório, o calorímetro mais simples que se pode encontrar é o do copo de café. É usado para medir o calor absorvido ou liberado em uma reação a pressão constante, em solução aquosa. As reações são selecionadas para evitar a intervenção de reagentes ou produtos gasosos.
Quantidade de calor liberada na reação = quantidade de calor absorvida pelo calorímetro + quantidade de calor absorvida pela solução
A quantidade de calor absorvida pelo calorímetro é chamada de capacidade calorimétrica do calorímetro. Isso é determinado fornecendo uma quantidade conhecida de calor ao calorímetro com uma determinada massa de água. Em seguida, o aumento da temperatura do calorímetro e da solução contendo.
Com estes dados, e com a utilização do calor específico da água (4,18 J / g.ºC), pode-se calcular a capacidade calórica do calorímetro. Essa capacidade também é chamada de constante de calorímetro.
Por outro lado, o calor ganho pela solução aquosa é igual a m · ce · Δt. Na fórmula m = massa de água, ce = calor específico de água e Δt = variação de temperatura. Sabendo de tudo isso, você pode calcular a quantidade de calor liberada pela reação exotérmica.
Índice do artigo
- 1 História do calorímetro
- 2 partes
- 3 tipos e suas características
- 3.1 O copo de café
- 3.2 A bomba calorimétrica
- 3.3 O calorímetro adiabático
- 3.4 O calorímetro isoperibol
- 3.5 O calorímetro de fluxo
- 3.6 O calorímetro para calorimetria diferencial de varredura
- 4 aplicativos
- 4.1 Em Físicoquímica
- 4.2 Em sistemas biológicos
- 4.3 Calorímetro da bomba de oxigênio e poder calórico
- 5 referências
História do calorímetro
Em 1780, A. L. Lavoisier, um químico francês, considerado um dos pais da química, usou uma cobaia para medir a produção de calor por sua respiração.
Como? Usando um dispositivo semelhante a um calorímetro. O calor produzido pela cobaia foi evidenciado pelo degelo da neve que circundava o aparelho.
Os pesquisadores A. L Lavoisier (1743-1794) e P. S. Laplace (1749-1827) projetaram um calorímetro que era usado para medir o calor específico de um corpo pelo método de derretimento de gelo.
O calorímetro consistia em um copo cilíndrico de estanho envernizado, apoiado em um tripé e terminado internamente por um funil. No seu interior foi colocado outro copo, semelhante ao anterior, com um tubo que atravessava a câmara exterior e que era munido de uma chave. Dentro do segundo copo havia uma grade.
O ser ou objeto cujo calor específico deveria ser determinado foi colocado nesta grade. O gelo foi colocado dentro dos copos concêntricos, como na cesta.
O calor produzido pelo corpo foi absorvido pelo gelo, fazendo-o derreter. E o produto líquido da água do derretimento do gelo foi coletado, abrindo a torneira de vidro interna.
E finalmente, a água pesou, a massa do gelo derretido era conhecida.
Peças
O calorímetro mais utilizado em laboratórios de ensino de química é o chamado calorímetro da xícara de café. Este calorímetro consiste em um béquer, ou em vez disso, um recipiente de material de anime que possui certas propriedades isolantes. Dentro deste recipiente a solução aquosa é colocada com o corpo que vai produzir ou absorver calor.
Uma tampa de material isolante com dois orifícios é colocada na parte superior do recipiente. Em uma delas é inserido um termômetro para medir as variações de temperatura, e na outra um agitador, preferencialmente feito de material de vidro, que cumpre a função de movimentar o conteúdo da solução aquosa..
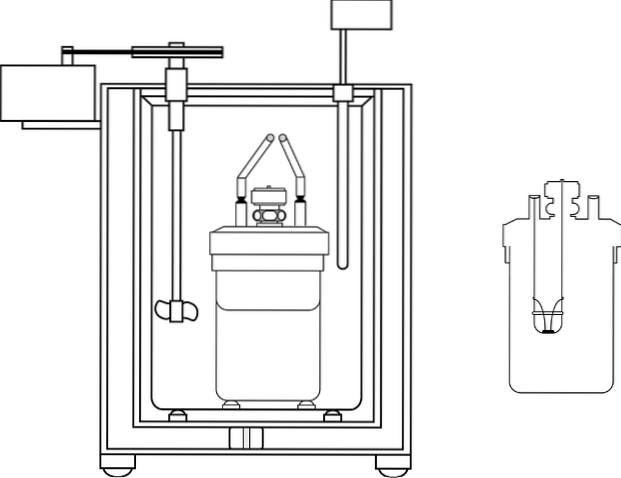
A imagem mostra as partes de um calorímetro de bomba; Porém, pode-se observar que possui o termômetro e o agitador, elementos comuns em vários calorímetros..
Tipos e suas características
A xícara de café
É aquele que é usado na determinação do calor liberado por uma reação exotérmica e do calor absorvido por uma reação endotérmica..
Além disso, pode ser usado para determinar o calor específico de um corpo; ou seja, a quantidade de calor que um grama da substância precisa absorver para aumentar sua temperatura em um grau Celsius. .
A bomba calorimétrica
É um dispositivo no qual a quantidade de calor que é emitida ou absorvida em uma reação que ocorre em volume constante é medida.
A reação ocorre em um recipiente de aço resistente (a bomba), que é imerso em um grande volume de água. Isso mantém as mudanças de temperatura da água pequenas. Portanto, assume-se que as mudanças associadas à reação são medidas em volume e temperatura constantes..
O acima indica que nenhum trabalho é feito quando uma reação é realizada em um calorímetro de bomba.
A reação começa com o fornecimento de eletricidade por meio de cabos conectados à bomba.
O calorímetro adiabático
É caracterizado por possuir uma estrutura isolante denominada blindagem. O escudo está localizado ao redor da célula onde ocorrem mudanças de calor e temperatura. Da mesma forma, está conectado a um sistema eletrônico que mantém sua temperatura muito próxima à da célula, para evitar a transferência de calor..
Em um calorímetro adiabático, a diferença de temperatura entre o calorímetro e seus arredores é minimizada; bem como minimizar o coeficiente de transferência de calor e o tempo para troca de calor.
Suas partes consistem no seguinte:
-A célula (ou recipiente), integrada em um sistema de isolamento por meio do qual tenta evitar a perda de calor.
-O termômetro, para medir as mudanças de temperatura.
-Um aquecedor, conectado a uma fonte controlável de voltagem elétrica.
-E o escudo, já mencionado.
Neste tipo de calorímetro, propriedades como entropia, temperatura de Debye e densidade eletrônica do estado podem ser determinadas..
O calorímetro isoperibol
É um dispositivo no qual a célula de reação e a bomba estão imersas em uma estrutura chamada camisa. Neste caso, a chamada camisa é constituída por água, mantida a uma temperatura constante.
As temperaturas da célula e da bomba aumentam conforme o calor é liberado durante o processo de combustão; mas a temperatura da camisa de água é mantida em uma temperatura fixa.
Um microprocessador controla a temperatura da célula e da camisa, fazendo as correções necessárias para o calor de vazamento que resulta das diferenças entre as duas temperaturas..
Essas correções são aplicadas continuamente, e com uma correção final, com base nas medições antes e depois do teste..
O calorímetro de fluxo
Desenvolvido pela Caliendar, possui um dispositivo para movimentar um gás em um recipiente em velocidade constante. Ao adicionar calor, o aumento da temperatura no fluido é medido.
O calorímetro de fluxo é caracterizado por:
- Uma medição precisa da velocidade de fluxo constante.
- Medição precisa da quantidade de calor introduzida no fluido por meio de um aquecedor.
- Uma medição precisa do aumento de temperatura no gás causado pela entrada de energia
- Um projeto para medir a capacidade de um gás sob pressão.
O calorímetro para calorimetria diferencial de varredura
Caracteriza-se por possuir dois recipientes: em um é colocada a amostra a ser estudada, enquanto o outro é mantido vazio ou é utilizado um material de referência..
Os dois recipientes são aquecidos a uma taxa constante de energia, por meio de dois aquecedores independentes. Quando os dois recipientes começarem a aquecer, o computador representará a diferença no fluxo de calor dos aquecedores em relação à temperatura, permitindo assim que o fluxo de calor seja determinado..
Além disso, a variação da temperatura em função do tempo pode ser determinada; e finalmente, a capacidade calórica.
Formulários
Em fisicoquímica
-Os calorímetros básicos, tipo xícara de café, permitem medir a quantidade de calor que um corpo emite ou absorve. Neles é possível determinar se uma reação é exotérmica ou endotérmica. Além disso, o calor específico de um corpo pode ser determinado.
-Com o calorímetro adiabático foi possível determinar a entropia de um processo químico e a densidade eletrônica do estado..
Em sistemas biológicos
-Microcalorímetros são usados para estudar sistemas biológicos que incluem interações entre moléculas, bem como as mudanças conformacionais moleculares que ocorrem; por exemplo, no desdobramento de uma molécula. A linha inclui varredura diferencial e titulação isotérmica.
-O microcalorímetro é utilizado no desenvolvimento de medicamentos de pequenas moléculas, bioterapêuticos e vacinas.
Calorímetro da bomba de oxigênio e potência calórica
No calorímetro da bomba de oxigênio, ocorre a combustão de inúmeras substâncias e seu valor calórico pode ser determinado. Entre as substâncias estudadas com esse calorímetro estão: carvão e coque; óleos comestíveis, pesados e leves; gasolina e todos os combustíveis de motor.
Bem como os tipos de combustíveis para reatores de aeronaves; desperdício de combustível e eliminação de resíduos; produtos e suplementos alimentares para nutrição humana; culturas forrageiras e suplementos para alimentação animal; materiais de construção; combustíveis para foguetes e propelentes.
Da mesma forma, o poder calórico foi determinado por calorimetria em estudos termodinâmicos de materiais combustíveis; no estudo do balanço energético em ecologia; em explosivos e pós térmicos e no ensino de métodos termodinâmicos básicos.
Referências
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning.
- González J., Cortés L. & Sánchez A. (s.f.). Calorimetria adiabática e suas aplicações. Recuperado de: cenam.mx
- Wikipedia. (2018). Calorímetro. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 de junho de 2018). Definição de Calorímetro em Química. Recuperado de: Thoughtco.com
- Gillespie, Claire. (11 de abril de 2018). Como funciona um calorímetro? Ciência. Recuperado de: sciencing.com



Ainda sem comentários