
Notação nuclear do Carbono 12, história, comentários
O carbono-12 é o isótopo mais abundante do elemento carbono, com 98,93% de abundância. Além disso, é o principal responsável por todas as propriedades e aplicações atribuídas ao elemento carbono..
O 12C, com massa atômica de exatamente 12 daltons, serve de referência para estabelecer as massas atômicas dos demais nuclídeos. O átomo de 12C consiste em seis prótons, nêutrons e elétrons; no entanto, a massa dos elétrons é considerada insignificante.
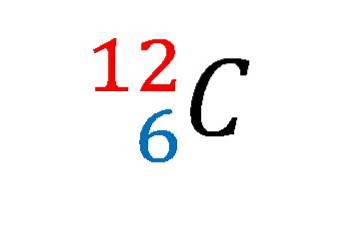
Os elementos geralmente têm massas atômicas expressas como números inteiros, seguidos por decimais, porque os elementos podem ter vários isótopos estáveis.
Portanto, as massas atômicas dos elementos são expressas como a média ponderada das massas atômicas de seus diferentes isótopos. Considerando que o 12C tem uma abundância de 98,93%, e o 13C uma abundância de 1,15%, a massa atômica do carbono é 12,011 daltons.
A massa atômica de um elemento é expressa como a média das massas atômicas de seus diferentes átomos em relação a um duodécimo da massa do elemento. 12C, conhecido como unidade de massa atômica unificada; anteriormente abreviado como "uma" e atualmente como "u".
Índice do artigo
- 1 notação nuclear
- 2 História
- 3 comentários gerais
- 4 referências
Notação nuclear
Na imagem acima, a notação ou símbolo nuclear para o isótopo carbono-12 foi mostrado.
Descrevê-lo é o mesmo que estabelecer as características do átomo de carbono por excelência. Seu número atômico 6 indica o número de prótons em seu núcleo. O número 12 é igual à soma dos prótons e nêutrons e, portanto, é a massa atômica; que é proporcional à massa nuclear.
E embora essa notação não mostre isso, existem 6 elétrons que neutralizam a carga positiva dos prótons no núcleo. Do ponto de vista das ligações químicas, quatro desses seis elétrons são os que estabelecem as bases da vida como a conhecemos..
História
A pesquisa de Dalton (1810) indicou que a água continha uma porcentagem de oxigênio de 87,7% e de hidrogênio de 12,5%. Mas, Dalton apontou que a fórmula para a água era OH. Davy e Berzelius (1812) corrigiram a fórmula da água para HdoisOU.
Posteriormente, Berzelius encontrou a seguinte composição da água: oxigênio 88,8% e hidrogênio 11,2%. Ele considerou que o peso atômico do hidrogênio é de 1 ge do oxigênio de 16 g..
Então, eles perceberam que usando o peso atômico de 1 g para o hidrogênio, o peso atômico do oxigênio seria de 15,9 g. Esse motivo, entre outros, levou ao estabelecimento da massa atômica do oxigênio de 16 g como padrão de referência para as massas atômicas dos diferentes elementos químicos..
O oxigênio foi usado como padrão de referência do final do século 19 até 1961, quando se decidiu usar o carbono como padrão de referência para estabelecer as massas atômicas dos diferentes elementos..
Antes de 1959, IUPAP e IUPAC usavam o elemento oxigênio para definir o mol da seguinte forma: 1 mol é o número de átomos de oxigênio presentes em 16 g.
Comentários gerais
Falar sobre 12C é para se referir ao carbono como um todo; ou pelo menos 98% de sua essência, o que é suficiente para tal aproximação. É por isso que esse isótopo não tem uso em si mesmo, enquanto o elemento como tal e os sólidos que ele integra cobrem centenas de aplicações..
No entanto, deve-se notar que os organismos vivos têm uma preferência especial por este isótopo do que por 13C; ou seja, a porcentagem de 13C ou a relação 12C /13C varia de acordo com ecossistemas, regiões ou espécies animais.
Talvez isso seja porque as moléculas com muitos átomos de carbono 13C, mais pesado, atrapalha ou prejudica os processos metabólicos e o funcionamento das células do corpo; mesmo se a porcentagem de 13C em seres vivos era pouco mais de 1%.
Portanto, o 12C é o isótopo do carbono responsável pela vida. E ele 14C o "medidor de tempo" de seus restos, graças ao seu decaimento radioativo.
Outra utilidade indireta de 12C é criar "contraste" para a técnica de espectroscopia de ressonância magnética nuclear do 13C, com o qual a estrutura de carbono dos compostos orgânicos pode ser elucidada (descoberta e construída).
Referências
- Phillips, Basil. (08 de julho de 2019). Qual é o isótopo mais comum de carbono? sciencing.com. Recuperado de: sciencing.com
- César Tomé López. (2019). Dos pesos atômicos. Recuperado de: culturacientifica.com
- ElSevier. (2019). Carbon-12. ScienceDirect. Recuperado de: sciencedirect.com
- R. Ship. (s.f.). Notação nuclear. Recuperado de: hyperphysics.phy-astr.gsu.edu
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.


Ainda sem comentários