
Componentes das células eletroquímicas, como funcionam, tipos, exemplo
As células eletroquímicas São dispositivos nos quais ocorrem reações químicas, onde a energia química é transformada em energia elétrica ou vice-versa. Essas células constituem o coração da eletroquímica, sendo a alma a troca potencial de elétrons que pode ocorrer, espontaneamente ou não, entre duas espécies químicas..
Uma das duas espécies oxida, perde elétrons, enquanto a outra se reduz, ganhando os elétrons transferidos. Comumente, a espécie que se reduz é um cátion metálico em solução, que ao ganhar elétrons acaba sendo depositado eletricamente sobre um eletrodo do mesmo metal. Por outro lado, a espécie que oxida é um metal, transformando-se em cátions metálicos.
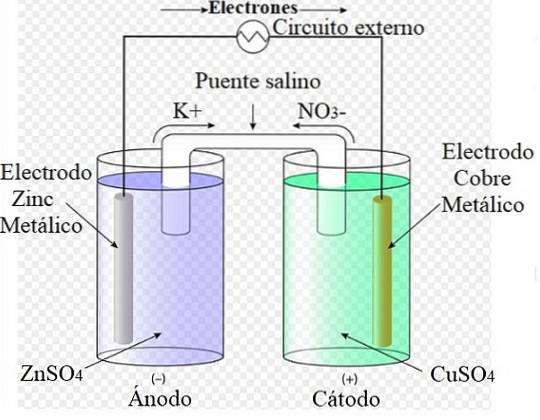
Por exemplo, a imagem acima representa a célula de Daniel: a mais simples de todas as células eletroquímicas. O eletrodo de zinco metálico oxida, liberando cátions Zndois+ para o meio aquoso. Isso ocorre no contêiner ZnSO4 à esquerda.
À direita, a solução contendo CuSO4 é reduzido, transformando os cátions Cudois+ em cobre metálico que é depositado no eletrodo de cobre. Durante o desenvolvimento dessa reação, os elétrons viajam por um circuito externo ativando seus mecanismos; e, portanto, fornecer energia elétrica para o funcionamento de uma equipe.
Índice do artigo
- 1 Componentes das células eletroquímicas
- 1.1 Eletrodos
- 1.2 Dissolução de eletrólitos
- 1.3 ponte salina
- 2 tipos de células eletroquímicas e como funcionam
- 2.1 Galvânico
- 2.2 Eletrolíticos
- 3 exemplos
- 3.1 Célula de Daniel
- 3.2 Platina e célula de hidrogênio
- 3.3 Célula de Downs
- 4 referências
Componentes da célula eletroquímica
Eletrodos
Correntes elétricas são geradas ou consumidas em células eletroquímicas. Para garantir um fluxo adequado de elétrons, deve haver materiais que sejam bons condutores de eletricidade. É aqui que entram os eletrodos e o circuito externo, fornecido com fios de cobre, prata ou ouro..
Os eletrodos são os materiais que fornecem a superfície onde ocorrerão as reações nas células eletroquímicas. Existem dois tipos de acordo com a reação que ocorre neles:
-Ânodo, eletrodo onde ocorre a oxidação
-Cátodo, eletrodo onde ocorre redução
Os eletrodos podem ser feitos de material reagente, como no caso da célula de Daniel (zinco e cobre); ou um material inerte, como quando são feitos de platina ou grafite.
Os elétrons liberados pelo ânodo devem atingir o cátodo; mas não através de uma solução, mas através de um cabo metálico que une os dois eletrodos a um circuito externo.
Dissolução de eletrólito
A solução que envolve os eletrodos também desempenha um papel importante, pois é enriquecida com eletrólitos fortes; tais como: KCl, KNO3, NaCl, etc. Esses íons favorecem, em certa medida, a migração de elétrons do ânodo para o cátodo, bem como sua condução pelas proximidades dos eletrodos para interagir com as espécies a serem reduzidas..
A água do mar, por exemplo, conduz eletricidade muito melhor do que a água destilada, com menor concentração de íons. É por isso que as células eletroquímicas têm uma dissolução de eletrólitos fortes entre seus componentes..
Ponte salina
Os íons da solução começam a envolver os eletrodos causando uma polarização das cargas. A solução ao redor do cátodo começa a ficar carregada negativamente, à medida que os cátions estão sendo reduzidos; no caso da célula de Daniel, os cátionsdois+ depositando-se como cobre metálico no cátodo. Assim, começa a haver um déficit de cargas positivas.
É aqui que a ponte salina intervém para equilibrar as cargas e evitar que os eletrodos se polarizem. Em direção ao lado ou compartimento do cátodo, os cátions migrarão da ponte de sal, seja K+ ou Zndois+, para suplantar o Cudois+ consumido. Enquanto isso, NENHUM ânions migrará da ponte de sal3- em direção ao compartimento anódico, para neutralizar a concentração crescente de cátions Zndois+.
A ponte salina é composta por uma solução saturada de sais, com suas extremidades cobertas por um gel permeável aos íons, mas impermeável à água..
Tipos de células eletroquímicas e como funcionam
O funcionamento de uma célula eletroquímica depende de seu tipo. Existem basicamente dois tipos: galvânico (ou voltaico) e eletrolítico.
Galvânico
A célula de Daniel é um exemplo de célula eletroquímica galvânica. Neles as reações ocorrem espontaneamente e o potencial da bateria é positivo; quanto maior o potencial, mais eletricidade a célula fornecerá.
As células ou baterias são precisamente células galvânicas: o potencial químico entre os dois eletrodos é transformado em energia elétrica quando um circuito externo intervém que os conecta. Assim, os elétrons migram do ânodo, acendem o equipamento ao qual a bateria está conectada e são devolvidos diretamente ao cátodo.
Eletrolítico
Células eletrolíticas são aquelas cujas reações não ocorrem espontaneamente, a menos que sejam alimentadas com energia elétrica de uma fonte externa. Aqui ocorre o fenômeno oposto: a eletricidade permite que reações químicas não espontâneas se desenvolvam.
Uma das reações mais conhecidas e valiosas que ocorrem dentro desse tipo de célula é a eletrólise..
As baterias recarregáveis são exemplos de células eletrolíticas e ao mesmo tempo galvânicas: elas são recarregadas para reverter suas reações químicas e restabelecer as condições iniciais para serem reutilizadas..
Exemplos
Celular do daniel
A seguinte equação química corresponde à reação na célula de Daniel onde o zinco e o cobre participam:
Zn (s) + Cudois+(aq) → Zndois+(aq) + Cu (s)
Mas os Cu cationsdois+ e Zndois+ eles não estão sozinhos, mas acompanhados pelos ânions SO4dois-. Esta célula pode ser representada da seguinte forma:
Zn | ZnSO4 | | CURSO4 | Cu
A célula de Daniel pode ser construída em qualquer laboratório, sendo muito recorrente como prática na introdução da eletroquímica. Como o Cudois+ é depositado como Cu, a cor azul da solução CuSO4 será perdido.
Célula de hidrogênio de platina
Imagine uma célula que consome gás hidrogênio, produz prata metálica e, ao mesmo tempo, fornece eletricidade. Esta é a célula de platina e hidrogênio, e sua reação geral é a seguinte:
2AgCl (s) + Hdois(g) → 2Ag (s) + 2H+ + 2Cl-
Aqui, no compartimento anódico, temos um eletrodo de platina inerte, imerso em água e no qual o gás hidrogênio é bombeado. O Hdois oxida a H+ e dá seus elétrons ao precipitado leitoso de AgCl no compartimento catódico com um eletrodo de prata metálica. Nesta prata o AgCl será reduzido e a massa do eletrodo aumentará..
Esta célula pode ser representada como:
Pt, Hdois | H+ | | Cl-, AgCl | Ag
Célula de Downs
E por fim, entre as células eletrolíticas, temos a célula de cloreto de sódio fundido, mais conhecida como célula de Downs. Aqui, a eletricidade é usada para que um volume de NaCl fundido passe pelos eletrodos, causando as seguintes reações neles:
2Na+(l) + 2e- → 2Na (s) (cátodo)
2Cl-(l) → Cldois(g) + 2e- (ânodo)
2NaCl (l) → 2Na (s) + Cldois(g) (reação global)
Assim, graças à eletricidade e ao cloreto de sódio, o sódio metálico e o gás cloro podem ser preparados..
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Wikipedia. (2020). Célula eletroquímica. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (29 de janeiro de 2020). Células eletroquímicas. Recuperado de: Thoughtco.com
- R. Ship. (s.f.). Células eletroquímicas. Recuperado de: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definição de Célula Eletroquímica. Recuperado de: chemicool.com
- Patricia Jankowski. (2020). O que é uma célula eletroquímica? - Estrutura e usos. Estudar. Recuperado de: study.com
- Alquimia (3 de março de 2011). Células eletroquímicas. Química e Ciência. Recuperado de: laquimicaylaciencia.blogspot.com



Ainda sem comentários