
Propriedades, usos, estruturas, riscos do cianeto de potássio (KCN),
O Cianeto de potássio é um composto inorgânico formado por um íon potássio K+ e um íon cianeto CN-. Sua fórmula química é KCN. É um sólido cristalino branco, extremamente venenoso.
O KCN é muito solúvel em água e quando dissolvido hidrolisa formando ácido cianídrico ou cianeto de hidrogênio HCN, que também é muito venenoso. O cianeto de potássio pode formar sais compostos com ouro e prata, razão pela qual era anteriormente usado para extrair esses metais preciosos de certos minerais..

O KCN é usado para revestir metais baratos com ouro e prata por meio de um processo eletroquímico, ou seja, um método em que uma corrente elétrica é passada por uma solução contendo um sal constituído pelo metal precioso, cianeto e potássio..
O cianeto de potássio, por conter cianeto, deve ser manuseado com muito cuidado, com utensílios adequados. Nunca deve ser descartado no meio ambiente, pois também é muito tóxico para a maioria dos animais e plantas..
No entanto, métodos usando algas comuns para remover o cianeto de potássio de águas contaminadas com baixas concentrações de cianeto de potássio estão sendo estudados..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Solubilidade
- 3,7 pH
- 3.8 Constante de hidrólise
- 3.9 Propriedades químicas
- 3.10 Outras propriedades
- 4 Obtendo
- 5 Uso em galvanoplastia de metais
- 5.1 Silver
- 5,2 ouro
- 5.3 Outros usos
- 6 riscos
- 7 Mecanismo de ação
- 7.1 Riscos adicionais
- 8 estudos recentes
- 9 referências
Estrutura
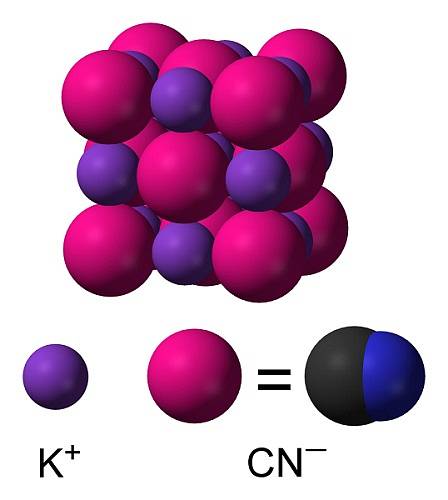
KCN é um composto iônico formado por um cátion potássio K+ e um ânion cianeto CN-. Neste, o átomo de carbono está ligado ao átomo de nitrogênio por uma ligação covalente tripla..

No cianeto de potássio sólido, o ânion CN- Ele pode girar livremente e se comportar como um ânion esférico, como consequência o cristal KCN tem uma estrutura cúbica semelhante à do cloreto de potássio KCl.
Nomenclatura
- Cianeto de potássio
- Cianeto de potássio
- Cianopotássio
Propriedades
Estado físico
Sólido cristalino branco. Cristais cúbicos.
Peso molecular
65,116 g / mol.
Ponto de fusão
634,5 ° C
Ponto de ebulição
1625 ° C.
Densidade
1,55 g / cm3 a 20 ° C.
Solubilidade
Muito solúvel em água: 716 g / L a 25 ° C e 100 g / 100 mL de água a 80 ° C. Ligeiramente solúvel em metanol: 4,91 g / 100 g de metanol a 19,5 ° C. Muito ligeiramente solúvel em etanol: 0,57 g / 100 g de etanol a 19,5 ° C.
pH
Uma solução aquosa de 6,5 g de KCN em 1 L de água tem um pH de 11,0.
Constante de hidrólise
KCN é muito solúvel em água. Quando se dissolve, o íon cianeto CN está livre- que leva um próton H+ de água para formar ácido cianídrico HCN e liberar um íon OH-:
CN- + HdoisO → HCN + OH-
A constante de hidrólise indica a tendência com a qual a referida reação é realizada.
Kh = 2,54 x 10-5
Soluções aquosas de KCN liberam cianeto de hidrogênio HCN no ambiente quando aquecidas acima de 80 ° C.
Propriedades quimicas
Não é inflamável, mas quando o KCN sólido é aquecido até a decomposição, emite gases muito tóxicos de cianeto de hidrogênio HCN, óxidos de nitrogênio NOx, óxido de potássio KdoisO e monóxido de carbono CO.
KCN reage com sais de ouro para formar aurocianeto de potássio KAu (CN)dois e potássio átrio KAu (CN)4. Estes são sais complexos incolores. Com o metal prateado Ag, KCN forma o argentocianeto de potássio KAg (CN)dois.
O íon cianeto do KCN reage com certos compostos orgânicos que possuem halogênios (como cloro ou bromo) e toma seu lugar. Por exemplo, ele reage com ácido bromoacético para dar ácido cianoacético..
Outras propriedades
É higroscópico, absorve umidade do meio ambiente.
Tem um cheiro suave de amêndoa amarga, mas não é detectado por todas as pessoas.
Obtendo
KCN é preparado pela reação de hidróxido de potássio KOH em solução aquosa com cianeto de hidrogênio HCN. Também é obtido por aquecimento de ferrocianeto de potássio K4Faith (CN)6:
K4Faith (CN)6 → 4 KCN + 2 C + Ndois↑ + Faith
Uso na galvanoplastia de metais
É usado no processo de revestimento de metais de baixo valor com ouro e prata. É um processo eletrolítico, ou seja, a eletricidade é passada por uma solução aquosa com os sais apropriados.
Prata
O argentocianeto de potássio KAg (CN) é usadodois para revestimento de prata (Ag) metais mais baratos.
Estes são colocados em uma solução aquosa de argentocianeto de potássio KAg (CN)dois, onde o ânodo ou pólo positivo é uma barra de prata pura (Ag) e o cátodo ou pólo negativo é o metal barato que você deseja revestir com prata.
Conforme uma corrente elétrica passa pela solução, a prata é depositada no outro metal. Quando os sais de cianeto são usados, a camada de prata é depositada de forma mais fina, compacta e aderente do que em soluções de outros compostos..

Ouro
Da mesma forma, no caso do ouro (Au), aurocianeto de potássio KAu (CN)dois e potássio átrio KAu (CN)4 são usados para dourar eletroliticamente outros metais.

Outros usos
Aqui estão alguns outros usos do cianeto de potássio.
- Para o processo industrial de endurecimento do aço por nitretação (adição de nitrogênio).
- Para limpeza de metal.
- Em processos de impressão e fotografia.
- Anteriormente, era usado para a extração de ouro e prata dos minerais que os contêm, mas posteriormente foi substituído pelo cianeto de sódio NaCN, que é mais barato, embora igualmente tóxico..
- Como inseticida para pulverizar árvores, navios, vagões e armazéns.
- Como um reagente em química analítica, ou seja, para fazer análises químicas.
- Para preparar outros compostos químicos, como corantes e corantes.

Riscos
KCN é um composto muito venenoso para animais e para a maioria das plantas e microorganismos. É classificado como supertóxico. É letal mesmo em quantidades muito pequenas.
Seu efeito nocivo pode ocorrer por inalação, contato com a pele ou olhos ou ingestão. Inibe muitos processos metabólicos, especialmente as proteínas do sangue envolvidas no transporte de oxigênio, como a hemoglobina.
Afeta os órgãos ou sistemas mais sensíveis à privação de oxigênio, como o sistema nervoso central (cérebro), o sistema cardiovascular (coração e vasos sanguíneos) e os pulmões.

Mecanismo de ação
KCN interfere com a capacidade do corpo de usar oxigênio.
O íon cianeto CN- KCN tem uma alta afinidade com o íon férrico Fe3+, o que significa que quando o cianeto é absorvido, ele reage rapidamente com o Fe3+ de sangue e tecidos.
Desta forma, impede a respiração das células, que entram em estado de falta de oxigênio, pois embora tentem respirar, não conseguem utilizá-lo..
Em seguida, há um estado transitório de hiperapnéia (suspensão da respiração) e dor de cabeça e, finalmente, morte devido à parada respiratória..
Riscos adicionais
Quando aquecido, produz gases muito tóxicos, como HCN, óxidos de nitrogênio NOx, óxido de potássio KdoisO e monóxido de carbono CO.
Ao entrar em contato com a umidade, libera HCN, altamente inflamável e muito tóxico..
O KCN também é muito venenoso para os organismos aquáticos. Nunca deve ser descartado no meio ambiente, pois pode ocorrer contaminação das águas onde os animais bebem e os peixes habitam.
No entanto, existem bactérias que produzem cianeto, como Chromobacterium violaceum e algumas espécies de Pseudomonas.
Estudos recentes
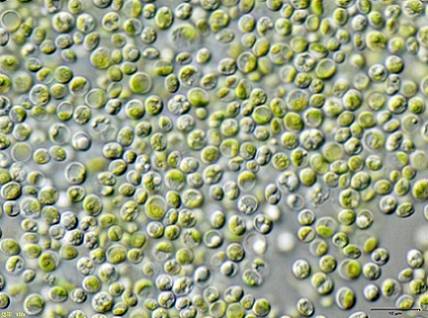
Certos pesquisadores descobriram que as algas verdes Chlorella vulgaris pode ser usado para tratar água contaminada com cianeto de potássio KCN em baixas concentrações.
A alga foi capaz de remover com eficiência o KCN, já que este em pequenas quantidades estimulou o crescimento das algas, pois ativou um mecanismo interno para resistir à toxicidade do KCN..
Isso significa que a alga Chlorella vulgaris tem o potencial de remover o cianeto e que um método eficaz para o tratamento biológico da contaminação por cianeto poderia ser desenvolvido com este.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Cianeto de potássio. Centro Nacional de Informações sobre Biotecnologia. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Coppock, R.W. (2009). Ameaças à vida selvagem por agentes de guerra química. In Handbook of Toxicology of Chemical Warfare Agents. Recuperado de sciencedirect.com.
- Liu, Q. (2017). Avaliação da remoção de cianeto de potássio e sua toxicidade em algas verdes (Chlorella vulgaris) Bull Environ Contam Toxicol. 2018; 100 (2): 228-233. Recuperado de ncbi.nlm.nih.gov.
- O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH). (2011). Cianeto de potássio: Agente Sistêmico. Recuperado de cdc.gov.
- Alvarado, L.J. et al. (2014). Riboswitch Discovery, Structure and Function. Síntese de Uracil. Em Methods in Enzymology. Recuperado de sciencedirect.com.
Ainda sem comentários