
Propriedades, riscos e usos do ácido arsênico (H3AsO3)
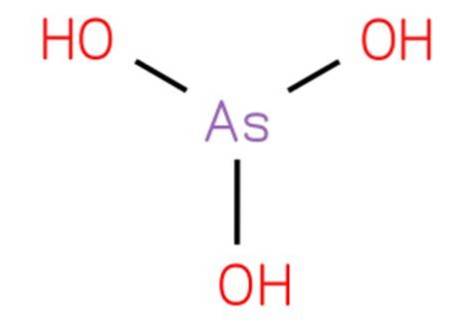
O ácido arsênico é um composto inorgânico de fórmula H3AsO3. Sua estrutura é análoga à triidroxiamina e pode ser reescrita como As (OH) 3. Apresenta-se em forma aquosa e não foi possível isolá-lo no estado sólido puro. Sua estrutura é apresentada na figura 1.
A elaboração do As (OH) 3 acarreta uma lenta hidrólise do trióxido de arsênio na água. A soma da base converte o ácido arsenoso em íons arsenito: [AsO (OH) 2] -, [AsO2 (OH)] 2- e [AsO3] 3-.
É um ácido fraco. As reações atribuídas ao trióxido de arsênio aquoso são devidas ao ácido arsênico e suas bases conjugadas.
Índice do artigo
- 1 Propriedades físicas e químicas do ácido arsênico
- 2 Reatividade e perigos
- 2.1 Em caso de contato com os olhos
- 2.2 Em caso de contato com a pele
- 2.3 Em caso de ingestão
- 2.4 Em caso de inalação
- 3 usos
- 4 referências
Propriedades físicas e químicas do ácido arsênico
O ácido arsênico é uma molécula piramidal que consiste em três grupos hidroxila ligados ao arsênio. O espectro de 1H NMR de soluções de ácido arsênico consiste em um único sinal consistente com a alta simetria da molécula. Só existe em solução aquosa.
A referida solução é incolor e não possui aroma característico. É armazenado em recipientes âmbar para evitar reação com a radiação UV (National Center for Biotechnology Information, 2017).

Seu peso molecular é 125,94 g / mol. Embora o composto não tenha sido isolado, suas propriedades foram calculadas usando métodos computacionais (© Royal Society of Chemistry, 2015), obtendo-se um ponto de fusão de 271,52 ° C, um ponto de ebulição de 626,14 ° C e uma solubilidade em água de 1 x 106 mg / l a 25 ° C.
O composto tem um pKa de 9,2 para a reação:
H3AsO3 ⇌ H2AsO3- + H+
A literatura relata que o composto tem um caráter anfotérico, embora se dissocie como uma base em um grau menor do que se dissocie como um ácido, com a base tendo um pKb de 14 para a reação:
As (OH) 3 ⇌ As (OH) 2+ + OH-
Isso leva à formação de espécies como sulfatos de hidróxido de arsênio ácido (As (OH) (HSO4) +, As (OH) 2 (HSO4)) em soluções concentradas de ácido sulfúrico ou à formação de sulfato de ácido arsênico (As (HSO4) ) 3) em soluções de ácido sulfúrico fumegante.
O ácido arsênico pode atuar como um agente oxidante ou um agente redutor, permanecendo como arsênio elementar ou ácido arsênico, respectivamente, de acordo com as semi-reações:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0,240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
O ácido arsênico é um agente oxidante mais forte do que sua contraparte fosfônica, mas um agente redutor mais fraco do que ele (Egon Wiberg, 2001).
Reatividade e perigos
O ácido arsenoso é um composto classificado como estável, porém é um reagente tóxico e corrosivo.
O composto apresenta um risco insignificante de incêndio e explosão quando exposto ao calor ou chamas. Neste caso, o recipiente deve ser movido se possível, evite respirar vapores ou poeira..
Quando aquecido, o composto libera vapores tóxicos e corrosivos de óxido de arsênio. Equipamento autônomo de respiração e roupas de proteção devem ser usados para evitar o contato em caso de incêndio.
Pode ser irritante para os olhos, pele e mucosas. Pode causar sensibilização. A intoxicação pode afetar os sistemas nervoso central, gastrointestinal e cardiovascular, fígado e rins. Compostos contendo arsênio são altamente tóxicos e cancerígenos.
Em caso de contato com os olhos
Lavar com água em abundância por pelo menos 15 minutos, levantando ocasionalmente as pálpebras até que não haja evidência de resíduos químicos.
Em caso de contato com a pele
Lave imediatamente com bastante água e sabão por pelo menos 15 minutos enquanto remove roupas e sapatos contaminados. As queimaduras são cobertas com um curativo esterilizado seco (seguro, não apertado).
Em caso de ingestão
Grandes quantidades de água devem ser fornecidas à vítima consciente para diluir o ácido. Não use lavagem gástrica nem induza o vômito. O pessoal médico deve manter as vias aéreas e a respiração.
Em caso de inalação
Deve-se administrar respiração artificial, se necessário. Mova a vítima para um local fresco e mantenha-a aquecida e em repouso.
Em todos os casos, deve-se procurar atendimento médico imediato (Folha de Dados de Segurança do Material Solução de ácido arsênico, 2007).
Formulários
O ácido arsênico é usado para detectar pequenas quantidades de iodo ou compostos de iodo. No trabalho de (Weegh, 1972) alguns aspectos da reação cérica do ácido arsênico foram estudados, atentando-se para as propriedades ópticas das soluções céricas..
Os efeitos cinéticos de vários compostos também foram estudados, especialmente os efeitos dos íons cloreto e brometo e os efeitos cinéticos do cloreto ou brometo em combinação com o iodeto..
O ácido arsênico também pode ser usado ilicitamente para causar abortos (Trend, 1858).
O ácido arsênico reage quando aquecido para formar trióxido de arsênio (As2O3). Este composto também é comumente conhecido pelo nome de ácido arsenoso, apesar de não ser o mesmo composto. A estrutura do trióxido de arsênio é apresentada na figura 3.
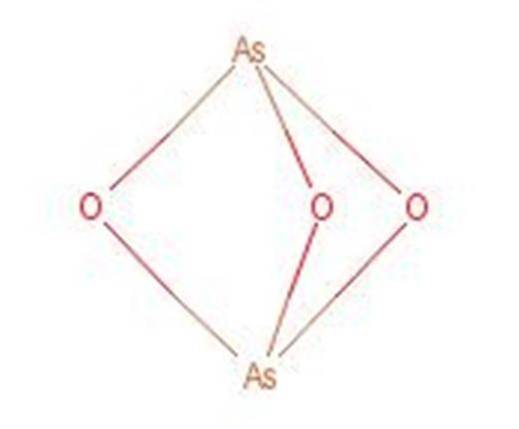
Figura 1: Estrutura do trióxido de arsênio.
Este composto, também conhecido como Trisenox, é usado para tratar pacientes com leucemia que não responderam a outros agentes. Este medicamento foi aprovado para uso pela Food and Drug Administration (FDA) dos EUA como tratamento para leucemia..
Como o composto funciona não está claro. Pode causar alterações morfológicas e fragmentação de DNA em células de leucemia promielocítica, causando morte celular e degradação ou dano de PML / RAR alfa (uma proteína de fusão) (Nurse's Drug Handbook 7th Ed, 2013).
Por ser venenoso para o corpo humano, é uma das drogas altamente discutíveis na área. O trióxido de arsênico foi usado pela primeira vez como um medicamento tradicional chinês chamado Pi Shuang. Ele ainda é usado hoje para tratar pacientes com câncer e outras condições de saúde. (Revisão de ácido arsênico, 2007-2016).
Referências
- © Royal Society of Chemistry. (2015). Ácido arsenoso. Recuperado de chemspider.
- © Royal Society of Chemistry. (2015). Triidroxiamina. Recuperado de chemspider.
- Revisão do ácido arsênico. (2007-2016). Recuperado de medicalook.
- Ácido arsenoso. (2014, 28 de julho). Recuperado de ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Química Inorgânica. Berlim: imprensa acadêmica.
- Folha de dados de segurança do material Solução de ácido arsênico. (2007, 10 de setembro). Recuperado de t3db.ca.
- Centro Nacional de Informações sobre Biotecnologia. (2017, 4 de março). PubChem Compound Database; CID = 545,. Obtido em PubChem.
- Nurse's Drug Handbook 7th Ed. (2013). McGraw-Hill.
- Trend, H. G. (1858). Um caso em que ácido arsenioso foi usado para obter aborto. comunicações originais do jornal médico britânico, 725-726.
- Weegh, W. H. (1972). O uso da reação do ácido arsênico cérico para a determinação de pequenas quantidades de iodo ou compostos de iodo. Clinica Chimica Acta Volume 39, Edição 2, 327-338.


Ainda sem comentários