
Estrutura, propriedades e usos do ácido clorídrico (HCl)

O ácido clorídrico (HCl) ou ácido muriático é um composto inorgânico que se forma pela dissolução em água do cloreto de hidrogênio, originando o íon hidrônio (H3OU+) e o íon cloreto (Cl-) Mais especificamente, é o hidrácido do cloro de halogênio com o hidrogênio.
O HCl é um ácido forte que se ioniza completamente em água e seus produtos de ionização são estáveis. A ionização completa de HCl é corroborada pelo fato de que o pH de uma solução de HCl 0,1 M é 1.

O principal método para a produção industrial de HCl é a cloração de compostos orgânicos para produzir, por exemplo, diclorometano, tricloroetileno, percloroetileno ou cloreto de vinila. HCl é um subproduto da reação de cloração.
É usado na titulação de bases em inúmeras reações químicas, na digestão química de compostos orgânicos, etc..
Os vapores de ácido clorídrico (cloreto de hidrogênio) podem causar lesões oculares graves. Além disso, podem causar irritação e graves problemas no trato respiratório.
O lúmen gástrico tem pH ácido (1-3) com alta concentração de HCl. A presença do ácido favorece a esterilização do conteúdo gástrico, inativando inúmeras bactérias presentes nos alimentos. Isso explicaria a gastroenterite associada à condição de acloridria.
Além disso, o HCl facilita a digestão de proteínas, ativando a enzima proteolítica pepsina..
É utilizado na limpeza de piscinas, normalmente basta um detergente comum mas existem manchas que aderem entre os ladrilhos, sendo necessária nestes casos a utilização de ácido clorídrico.
É usado no controle de pH em produtos farmacêuticos, alimentos e água potável. Ele também é usado na neutralização de fluxos de resíduos contendo material alcalino..
O ácido clorídrico é usado na regeneração de resinas de troca iônica, usadas para sequestrar íons metálicos ou outros tipos de íons na indústria, em laboratórios de pesquisa e na purificação de água potável..
Por outro lado, também se pode comentar que o cloreto de hidrogênio, um composto gasoso, é uma molécula diatômica e os átomos que a formam são unidos por uma ligação covalente. Enquanto isso, o ácido clorídrico é um composto iônico que em solução aquosa se dissocia em H+ e Cl-. A interação entre esses íons é eletrostática..
Índice do artigo
- 1 Estrutura química
- 2 treinamento
- 3 Onde está localizado?
- 3.1 Gastrina
- 3.2 Histamina
- 3,3 acetilcolina
- 3.4 Outras fontes de HCl biológico
- 4 Propriedades físicas e químicas
- 4.1 Peso molecular
- 4.2 Cor
- 4.3 Odor
- 4.4 Sabor
- 4.5 Ponto de ebulição
- 4.6 Ponto de fusão
- 4.7 Solubilidade em água
- 4.8 Solubilidade em metanol
- 4,9 Solubilidade em etanol
- 4.10 Solubilidade em éter
- 4.11 Densidade
- 4.12 Densidade do gás
- 4.13 Densidade de vapor
- 4.14 Pressão de vapor
- 4.15 Estabilidade
- 4.16 Autoignição
- 4.17 Decomposição
- 4.18 Corrosividade
- 4.19 Tensão superficial
- 4.20 Polimerização
- 5 usos
- 5.1 Industrial e doméstico
- 5.2 Síntese e reações químicas
- 6 Riscos e Toxicidade
- 7 Prevenção de danos por ácido clorídrico
- 8 referências
Estrutura química
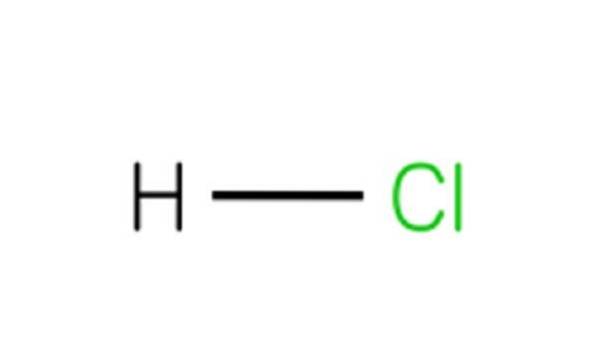
Cada molécula de HCl é composta por um átomo de hidrogênio e um átomo de cloro. Embora à temperatura ambiente o HCl seja venenoso e um gás incolor, se se dissolver em água, dá ácido clorídrico..
Treinamento

-Pode ser produzido por eletrólise de NaCl (cloreto de sódio) que dá origem a Hdois (g), Cldois (g), 2Na (ac) e OH- (ac). Mais tarde:
Hdois + Cldois => 2 HCl
Esta é uma reação exotérmica.
-O HCl é produzido pela reação de cloreto de sódio com ácido sulfúrico. Processo que pode ser descrito da seguinte maneira:
NaCl + HdoisSW4 => NaHSO4 + HCl
Em seguida, o cloreto de hidrogênio é coletado e o cloreto de sódio é reagido com o bissulfito de sódio de acordo com a seguinte reação:
NaCl + NaHSO4 => NadoisSW4 + HCl
Essa reação foi introduzida por Johan Glauber no século 17 para produzir ácido clorídrico. Atualmente é utilizado principalmente em laboratórios, visto que a importância de seu uso industrial tem diminuído.
-O ácido clorídrico pode ser produzido como um subproduto da cloração de compostos orgânicos, por exemplo: na produção de diclorometano.
CdoisH4 + Cldois => CdoisH4Cldois
CdoisH4Cldois => CdoisH3Cl + HCl
Este método de produção de HCl é mais utilizado industrialmente, calculando-se que 90% do HCl produzido nos Estados Unidos é por esta metodologia.
-E, finalmente, o HCl é produzido na incineração de resíduos orgânicos clorados:
C4H6Cldois + 5 Odois => 4 COdois + 2 hdoisO + 2 HCl
Onde está?
O ácido clorídrico concentra-se na luz gástrica onde se atinge o pH 1. A existência de uma barreira de muco, rica em bicarbonato, impede que as células gástricas sofram danos devido ao baixo pH gástrico..
Existem três estímulos fisiológicos principais para a secreção de H+ pelas células parietais do corpo gástrico: gastrina, histamina e acetilcolina.
Gastrin
A gastrina é um hormônio secretado na região do antro gástrico que atua aumentando a concentração intracelular de Ca, intermediário na ativação do transporte ativo de H+ em direção ao lúmen gástrico.
O transporte ativo é realizado por uma enzima ATPase que usa a energia contida no ATP para transportar H+ em direção ao lúmen gástrico e introduzir K+.
Histamina
É secretado pelas chamadas células semelhantes a enterocromafins (SEC) do corpo gástrico. Sua ação é mediada por um aumento na concentração de AMP cíclico e atua aumentando, como a gastrina, o transporte ativo de H+ em direção ao lúmen gástrico mediado por uma bomba H+-K+.
Acetilcolina
É secretado pelos terminais nervosos vagais, assim como a gastrina medeia sua ação por um aumento do Ca intracelular, ativando a ação da bomba H.+-K+.
O H+ das células parietais vem da reação de COdois com o HdoisO para formar HdoisCO3 (ácido carbónico). Este mais tarde se decompõe em H+ e HCO3-. O H+ é transportado ativamente para o lúmen gástrico através da membrana apical gástrica. Enquanto isso, o HCO3- é trazido para o sangue acoplado à entrada de Cl-.
O mecanismo de contra-transporte ou anti-transporte Cl-HCO3- que ocorre na membrana basal das células parietais produz o acúmulo intracelular de Cl-. Posteriormente, o íon passa para o lúmen gástrico que acompanha o H+. A secreção gástrica de HCl é estimada em uma concentração de 0,15 M.
Outras fontes de HCl biológico
Existem outros estímulos para a secreção de HCl pelas células parietais, como cafeína e álcool.
Úlceras gástricas e duodenais ocorrem quando a barreira que protege as células gástricas da ação danosa do HCl é rompida..
Ao eliminar a ação protetora mencionada, a bactéria Helicobacter pylori, o ácido acetilsalicílico e os antiinflamatórios não esteroidais (AINEs) contribuem para a produção de úlceras..
A secreção ácida tem a função de eliminar os micróbios presentes nos alimentos e iniciar a digestão das proteínas, por meio da ação da pepsina. As principais células do corpo gástrico secretam pepsinogênio, uma pró-enzima que é transformada em pepsina pelo baixo pH do lúmen gástrico..
Propriedades físicas e químicas
Peso molecular
36,458 g / mol.
Cor
É um líquido incolor ou ligeiramente amarelado.
Odor
É um cheiro acre irritante.
Gosto
O limite para degustação é água pura é uma concentração de 1,3 x 10-4 moles / l.
Ponto de ebulição
-121º F a 760 mmHg. -85,05º C a 760 mmHg.
Ponto de fusão
-174º F (-13,7º F) para uma solução de HCl 39,7% p / p em água), -114,22º C.
Solubilidade em água
A solução de HCl pode ser de 67% p / p a 86 ° F; 82,3 g / 100 g de água a 0 ° C; 67,3 g / 100 g de água a 30º C e 63,3 g / 100 g de água a 40º C.
Solubilidade em metanol
51,3 g / 100 g de solução a 0º C e 47 g / 100 de solução a 20º C
Solubilidade em etanol
41,0 / 100 g de solução a 20º C
Solubilidade em éter
24,9 g / 100 de solução a 20º C.
Densidade
1,059 g / ml a 59º F em uma solução de 10,17% p / p.
Densidade do gás
1.00045 g / L
Densidade do vapor
1.268 (em relação ao ar tomado como 1)
Pressão de vapor
32.452 mmHg a 70 ° F; 760 mmHg a -120,6º F
Estabilidade
Tem uma alta estabilidade térmica.
Autoignição
Não é inflamável.
Decomposição
Decompõe-se ao aquecer, emitindo fumaça de cloro tóxico.
Viscosidade: 0,405 cPoise (líquido a 118,6 º K), 0,0131 cPoise (vapor a 273,06 º K).
Corrosividade
É altamente corrosivo para alumínio, cobre e aço inoxidável. Ataca todos os metais (mercúrio, ouro, platina, prata, tântalo, exceto para certas ligas).
Tensão superficial
23 mN / cm a 118,6º K.
Polimerização
Aldeídos e epóxidos sofrem polimerização violenta na presença de ácido clorídrico.
As propriedades físicas, como viscosidade, pressão de vapor, ponto de ebulição e ponto de fusão são influenciadas pela concentração percentual p / p do HCl.
Formulários
O ácido clorídrico tem muitos usos em casa, em diferentes indústrias, em laboratórios de ensino e pesquisa, etc..
Industrial e doméstica
-O ácido clorídrico é usado no processamento hidrometalúrgico, por exemplo, na produção de alumina e dióxido de titânio. É utilizado na ativação da produção de poços de petróleo.
A injeção do ácido aumenta a porosidade ao redor do óleo, favorecendo sua extração..
-É usado para a remoção de depósitos de CaCO3 (carbonato de cálcio) por sua transformação em CaCldois (cloreto de cálcio) que é mais solúvel e mais fácil de remover. Da mesma forma, é utilizado industrialmente no beneficiamento do aço, um material com diversos usos e aplicações, tanto na indústria, na construção civil quanto no lar..
-Os maçons usam soluções de HCl para lavar e limpar os tijolos. É utilizado em casa para a limpeza e desinfecção de banheiros e seus ralos. Além disso, o ácido clorídrico é usado em gravações, incluindo operações de limpeza de metais..
-O ácido clorídrico tem aplicação na eliminação da camada de óxido de ferro bolorento que se acumula no aço, antes de seu posterior processamento em extrusão, laminação, galvanização, etc..
FédoisOU3 + Fe + 6 HCl => 3 FeCldois + HdoisOU
-Apesar de altamente corrosivo, é utilizado para remover manchas metálicas presentes em ferro, cobre e latão, na diluição 1:10 em água..
Síntese e reações químicas
-O ácido clorídrico é usado em reações de titulação de bases ou álcalis, bem como no ajuste do pH de soluções. Além disso, é utilizado em inúmeras reações químicas, por exemplo, na digestão de proteínas, procedimento anterior aos estudos do conteúdo de aminoácidos e sua identificação..
-O principal uso do ácido clorídrico é a produção de compostos orgânicos, como cloreto de vinila e diclorometano. O ácido é um intermediário na produção de policarbonatos, carvão ativado e ácido ascórbico.
-É utilizado na fabricação de cola. Já na indústria têxtil, é utilizado no branqueamento de tecidos. É utilizado na indústria de curtimento de couro, intervindo no seu processamento. Também é utilizado como fertilizante e na produção de cloro, corantes, etc. Também é usado em galvanoplastia, fotografia e indústria da borracha..
-É utilizado na produção de seda artificial, no refino de óleos, gorduras e sabões. Além disso, é utilizado em reações de polimerização, isomerização e alquilação..
Riscos e Toxicidade
Tem ação corrosiva na pele e nas mucosas, causando queimaduras. Estes, se graves, podem causar ulcerações, deixando cicatrizes quelóides e retráteis. O contato com os olhos pode causar redução ou perda total da visão devido a danos na córnea..
Quando o ácido atinge o rosto, pode causar ciclos graves que desfiguram o rosto. O contato frequente com o ácido também pode causar dermatite..
A ingestão de ácido clorídrico queima a boca, garganta, esôfago e trato gastrointestinal, causando náuseas, vômitos e diarreia. Em casos extremos, pode ocorrer perfuração do esôfago e do intestino, com parada cardíaca e morte..
Por outro lado, os vapores ácidos, dependendo da concentração, podem causar irritação do trato respiratório, causando faringite, edema da glote, estreitamento dos brônquios com bronquite, cianose e edema pulmonar (acúmulo excessivo de líquido nos pulmões) e em casos extremos, morte.
A exposição a altos níveis de vapores ácidos pode causar inchaço e espasmo na garganta, com conseqüente asfixia..
As necroses dentais que aparecem nos dentes com a perda do brilho também são frequentes; tornam-se amarelados e moles, eventualmente quebrando.
Prevenção de danos por ácido clorídrico
Existe um conjunto de regras para a segurança das pessoas que trabalham com ácido clorídrico:
-Pessoas com histórico de doenças respiratórias e digestivas não devem trabalhar em ambientes com presença de ácido..
-Os trabalhadores devem usar roupas resistentes a ácidos, mesmo com capuzes; óculos de proteção ocular, protetores de braço, luvas resistentes a ácidos e sapatos com as mesmas características. Eles também devem usar máscaras de gás e em casos de exposição severa a vapores de ácido clorídrico, o uso de aparelho de respiração autônomo é recomendado..
-O ambiente de trabalho também deve possuir chuveiros de emergência e fontes para lavagem dos olhos..
-Além disso, existem normas para ambientes de trabalho, como tipo de piso, circuitos fechados, proteção de equipamentos elétricos, etc..
Referências
- StudiousGuy. (2018). Ácido clorídrico (HCl): usos e aplicações importantes. Retirado de: studiousguy.com
- Ganong, W. F. (2003). Review of Medical Physiology. Vigésima primeira edição. The McGraw-Hill Companies INC.
- PubChem. (2018). Ácido clorídrico. Retirado de: pubchem.ncbi.nlm.nih.gov
- Weebly. Ácido clorídrico. Retirado de: psa-hydrochloric-acid.weebly.com
- CTR. Folha de dados de segurança do ácido clorídrico. [PDF]. Retirado de: uacj.mx


Ainda sem comentários