
Fórmula, propriedades e usos do ácido cloroso (HClO2)

O ácido cloroso é um composto inorgânico com a fórmula HClOdois. O referido ácido é um dos ácidos oxácido do cloro onde está no estado de oxidação 3+. Embora o ácido seja difícil de ser obtido em sua substância pura, a base conjugada derivada desses ácidos, o íon clorito, é estável..
Um exemplo de sal desse ânion é o conhecido clorito de sódio. Este e os sais relacionados às vezes são usados na produção de dióxido de cloro..
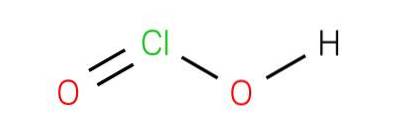
O ácido cloroso é um ácido fraco. A substância pura é instável, desproporcional ao ácido hipocloroso (estado de oxidação Cl +1) e ácido clórico (estado de oxidação Cl +5):
2HClOdois → HClO + HClO3
O ácido cloroso é obtido, junto com o ácido clórico, na decomposição da solução aquosa de dióxido de cloro.
A solução de ácido cloroso foi obtida pela primeira vez reduzindo o ácido clórico com ácido tartárico (A. J. Downs, 1973), entretanto, o principal método de obtenção desse ácido é pelo tratamento de uma suspensão de cloreto de bário com ácido sulfúrico:
Ba (ClOdois)dois + HdoisSW4 → BaSO4 + 2HClOdois
O ácido cloroso é um poderoso agente oxidante, embora sua tendência à dismutação ou desproporção neutralize seu potencial oxidante..
O cloro é o único halogênio que forma um ácido isolável de fórmula HXOdois. Nem o ácido bromo nem o ácido iodo foram isolados. Alguns sais de ácido bromoso, bromitos, são conhecidos, mas, exceto como intermediários nas reações, não existem sais de iodito..
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 3 usos
- 4 referências
Propriedades físicas e químicas
O ácido cloroso, quando isolado, é um líquido incolor sem aroma característico (National Center for Biotechnology Information, 2017).
O composto tem um peso molecular de 68,456 g / mol. Tem um ponto de ebulição (calculado) de 502,07 ° C e uma solubilidade em água (calculada) de 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClOdois é instável devido à reação de dismutação (ou desproporcionamento) para produzir ácido clorídrico e hipocloroso (C. C. Hong, 1968) semelhante ao do bromo analógico e ácidos de iodo:
2HClOdois → HClO + HClO3
O ácido cloroso é considerado um ácido fraco, embora sua constante de dissociação seja da ordem de 1 x 10-dois o que não o torna tão fraco quanto outros ácidos com um pKa de 1,96.
Reatividade e perigos
O ácido cloroso é um composto instável e um forte agente oxidante incompatível com agentes redutores e álcalis..
O ácido cloroso irrita em caso de contato com a pele e os olhos, e é perigoso em casos de ingestão e inalação.
Em caso de contato com os olhos, verifique se está usando lentes de contato e remova-as imediatamente. Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada. Pomada para os olhos não deve ser usada.
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas mãos e corpo. Coloque a vítima sob um chuveiro de emergência.
Se o produto químico se acumular na pele exposta da vítima, como nas mãos, a pele contaminada deve ser lavada com cuidado e cuidado com água corrente e sabão não abrasivo..
Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de usá-la novamente.
Se o contato com a pele for grave, deve-se lavar com sabonete desinfetante e cobrir a pele contaminada com creme antibacteriano..
Em caso de inalação, a vítima deve ser deixada repousar em área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível. Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata.
Se a vítima tiver dificuldade para respirar, deve-se administrar oxigênio. Se a vítima não estiver respirando, a ressuscitação boca a boca é realizada. Sempre tendo em mente que pode ser perigoso para a pessoa que está prestando socorro fazer reanimação boca a boca quando o material inalado for tóxico, infeccioso ou corrosivo..
Se ingerido, não induza o vômito. Afrouxe roupas apertadas, como golas de camisa, cintos ou gravatas. Se a vítima não estiver respirando, faça a ressuscitação boca a boca. Em todos os casos, procure atendimento médico imediatamente..
Formulários
Estudos foram conduzidos onde soluções metaestáveis de ácido cloroso / óxido de cloro são usadas como enxaguatório bucal para a redução da placa (Goultschin J, 1989).
O estudo foi feito em um grupo de 18 voluntários com idade entre 20-27 anos. Seu efeito no desenvolvimento da placa e na contagem bacteriana salivar foi testado, obtendo-se uma redução de até 34,5% nos escores da placa dentária em comparação com o grupo placebo.
O ácido cloroso está envolvido na preparação de clorito de ácido de sódio, que possui propriedades antimicrobianas e se destina a ser usado principalmente como spray ou solução de imersão para aves, carnes, vegetais, frutas e frutos do mar. Também usado na água de resfriamento de aves.
O clorito de ácido de sódio é produzido pela adição de um ácido de qualidade alimentar (por exemplo, ácido cítrico, ácido fosfórico, ácido clorídrico, ácido málico ou hidrogenossulfato de sódio) a uma solução aquosa de clorito de sódio (NaClOdois).
A combinação do ácido com a solução de clorito de sódio resulta na conversão de clorito em ácido cloroso metaestável (HClOdois).
NaClOdois + H+ ⇌ HClOdois + N / D+
Esta solução pode posteriormente formar uma mistura com clorito (ClOdois-), dióxido de cloro (ClOdois) e cloreto (Cl¯). A reação gera uma solução oxidativa com espécies oxicloradas com propriedades antimicrobianas.
O Clorito de Ácido Sódico é projetado para ser usado como parte de uma abordagem integrada projetada para controlar cargas microbianas em alimentos.
A solução de clorito de ácido de sódio atua para reduzir o número de patógenos (por exemplo, Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp., E Listeria monocytogenes) (Rao, 2006).
Referências
- J. Downs, C. J. (1973). A Química do Cloro, Bromo, Iodo e Astatino: Pergamon ..., Volume 7. Nova York: imprensa Pergamon.
- C. Hong, W. H. (1968). Cinética de desproporção de ácido cloroso. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (2014, 28 de julho). ácido cloroso. Recuperado de ChEBI: ebi.ac.uk.
- Goultschin J, G. J. (1989). Uso de uma formulação metastabilizada de ácido cloroso / dióxido de cloro como enxaguatório bucal para redução de placa. Isr J Dent Sci. 2 (3), 142-147. ncbi.nlm.nih.gov.
- National Center for Biotechnology Information ... (2017, 30 de abril). Banco de dados de compostos PubChem CID = 24453. Obtido em PubChem.
- Rao, M. V. (dezembro de 2006). CLORITO DE SÓDIO ACIDIFICADO (ASC) Avaliação Química e Técnica. Recuperado de fao.org.
- Royal Society of Chemistry. (2015). Ácido cloroso. Recuperado de chemspider.com.


Ainda sem comentários