
Propriedades, riscos e utilizações do ácido fosforoso (H3PO3)

O ácido fosforoso, também chamado de ácido ortofosforoso, é um composto químico de fórmula H3PO3. É um dos vários ácidos oxigenados de fósforo e sua estrutura é apresentada na figura 1 (EMBL-EBI, 2015).
Dada a fórmula do composto, ele pode ser reescrito como HPO (OH)dois. Esta espécie existe em equilíbrio com um tautômero menor P (OH)3 (Figura 2).

As recomendações da IUPAC, 2005 são que este último seja denominado ácido fosforoso, enquanto a forma dihidroxi seja denominada ácido fosfônico. Apenas os compostos de fósforo reduzidos são soletrados com uma terminação "urso"..

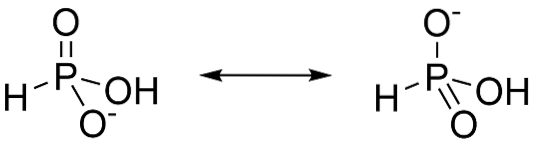
O ácido fosforoso é um ácido diprótico, o que significa que ele só tem a capacidade de liberar dois prótons. Isso ocorre porque o tautômero majoritário é H3PO3. Quando esta forma perde um próton, a ressonância estabiliza os ânions formados, conforme mostrado na figura 3.
O tautômero P (OH) 3 (Figura 4) não tem o benefício de estabilização de ressonância. Isso torna a remoção do terceiro próton muito mais difícil (por que o ácido fosforoso é diprótico e não triprótico?, 2016).

Ácido fosfórico (H3PO3) forma sais chamados fosfitos, que são usados como agentes redutores (Britannica, 1998). É preparado dissolvendo hexóxido tetrafosfórico (P4OU6) de acordo com a equação:
P4OU6 + 6 hdoisO → 4 HPO (OH)dois
Ácido fosforoso puro, H3PO3, melhor preparado por hidrólise de tricloreto de fósforo, PCl3.
PCl3 + 3HdoisO → HPO (OH)dois + 3HCl
A solução resultante é aquecida para expulsar o HCl, e a água restante é evaporada até que apareça 3PO3 cristalino incolor no resfriamento. O ácido também pode ser obtido pela ação da água sobre o PBr3 ou PI3 (Zumdahl, 2018).
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 2.1 Reatividade
- 2.2 Riscos
- 2.3 Ação em caso de dano
- 3 usos
- 4 referências
Propriedades físicas e químicas
Os ácidos de fósforo são cristais tetraédricos higroscópicos brancos ou amarelos com um aroma de alho (National Center for Biotechnology Information, 2017).

O H3PO3 tem um peso molecular de 82,0 g / mol e uma densidade de 1,651 g / ml. O composto tem um ponto de fusão de 73 ° C e se decompõe acima de 200 ° C. O ácido fosforoso é solúvel em água, sendo capaz de dissolver 310 gramas por 100 ml deste solvente. Também é solúvel em etanol.
Além disso, é um ácido forte com um pKa entre 1,3 e 1,6 (Royal Society of Chemistry, 2015).
O aquecimento do ácido fosfórico a cerca de 200 ° C faz com que ele se torne desproporcional em ácido fosfórico e fosfina (PH3) Fosfina, um gás que normalmente se inflama espontaneamente no ar.
4h3PO3 + calor → PH3 + 3H3PO4
Reatividade e perigos
Reatividade
- O ácido fosforoso não é um composto estável.
- Absorve oxigênio do ar para formar ácido fosfórico.
- Forma depósitos amarelos em solução aquosa que são espontaneamente inflamáveis na secagem.
- Reage exotermicamente com bases químicas (por exemplo: aminas e hidróxidos inorgânicos) para formar sais.
- Essas reações podem gerar quantidades perigosamente grandes de calor em pequenos espaços..
- Dissolver em água ou diluir uma solução concentrada com água adicional pode gerar calor significativo.
- Reage na presença de umidade com metais ativos, incluindo metais estruturais como alumínio e ferro, para liberar hidrogênio, um gás inflamável.
- Pode iniciar a polimerização de certos alcenos. Reage com compostos de cianeto para liberar cianeto de hidrogênio gasoso.
- Pode gerar gases inflamáveis e / ou tóxicos em contato com ditiocarbamatos, isocianatos, mercaptanos, nitretos, nitrilos, sulfetos e fortes agentes redutores.
- Reações adicionais de geração de gás ocorrem com sulfitos, nitritos, tiossulfatos (para dar H2S e SO3), ditionitos (para dar SO2) e carbonatos (para dar CO2) (ÁCIDO FÓSFORO, 2016).
Perigos
- O composto é corrosivo para os olhos e pele.
- O contato com os olhos pode resultar em danos à córnea ou cegueira..
- O contato com a pele pode causar inflamação e bolhas.
- A inalação de poeira produzirá irritação do trato gastrointestinal ou respiratório, caracterizada por ardor, espirros e tosse..
- A superexposição severa pode causar danos aos pulmões, sufocação, perda de consciência ou morte (Folha de Dados de Segurança do Material Ácido Fosforoso, 2013).
Ação em caso de dano
- Garantir que o pessoal médico esteja ciente dos materiais envolvidos e tome precauções para se proteger.
- A vítima deve ser removida para um local fresco e o serviço médico de emergência deve ser chamado.
- Deve-se administrar respiração artificial se a vítima não estiver respirando.
- O método boca-a-boca não deve ser usado se a vítima tiver ingerido ou inalado a substância..
- A respiração artificial é realizada com a ajuda de uma máscara de bolso equipada com uma válvula unidirecional ou outro dispositivo médico respiratório adequado.
- O oxigênio deve ser dado se a respiração estiver difícil.
- Roupas e sapatos contaminados devem ser removidos e isolados.
- Em caso de contato com a substância, enxágue imediatamente a pele ou os olhos com água corrente por pelo menos 20 minutos..
- Para menos contato com a pele, evite espalhar o material na pele não afetada..
- Mantenha a vítima calma e aquecida.
- Os efeitos da exposição (inalação, ingestão ou contato com a pele) à substância podem ser retardados.
Formulários
O uso mais importante do ácido fosforoso é a produção de fosfitos que são usados no tratamento de água. O ácido fosfórico também é usado para preparar sais de fosfito, como o fosfito de potássio..
Os fosfitos demonstraram ser eficazes no controle de uma variedade de doenças de plantas.
Em particular, o tratamento por tronco ou injeção foliar contendo sais de ácido fosforoso é indicado em resposta a infecções por patógenos de plantas do tipo phytoftera e pythium (eles causam decomposição da raiz).
O ácido fosforoso e os fosfitos são usados como agentes redutores em análises químicas. Uma nova síntese conveniente e escalonável de ácidos fenilacéticos, por meio da redução catalisada por iodeto de ácidos mandélicos, é baseada na geração in situ de ácido iodídrico a partir de iodeto de sódio catalítico. Para isso, o ácido fosfórico é usado como redutor estequiométrico (Jacqueline E. Milne, 2011).
É utilizado como ingrediente para a produção de aditivos utilizados na indústria de policloreto de vinila (ácido fosforoso (CAS RN 10294-56-1), 2017). Também ésteres de ácido fosforoso são usados em várias reações de síntese orgânica (Blazewska, 2009).
Referências
- Blazewska, K. (2009). Ciência de Síntese: Métodos Houben-Weyl de Transformações Moleculares Vol 42. New York: Thieme.
- (20 de julho de 1998). Ácido fosforoso (H3PO3). Recuperado da Encyclopædia Britannica: britannica.com.
- EMBL-EBI. (20 de julho de 2015). ácido fosfônico. Recuperado de ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Reduções Catalisadas por Iodeto: Desenvolvimento de uma Síntese de Ácidos Fenilacéticos. Org. Chem. 76, 9519-9524. organic-chemistry.org.
- Folha de dados de segurança do material Ácido fosforoso. (2013, 21 de maio). Recuperado do sciencelab: sciencelab.com.
- Centro Nacional de Informações sobre Biotecnologia. (2017, 11 de março). PubChem Compound Database; CID = 107909. Obtido em PubChem: ncbi.nlm.nih.gov.
- Ácido fosforoso (CAS RN 10294-56-1). (15 de março de 2017). Recuperado de gov.uk/trade-tariff:gov.uk.
- ÁCIDO FÓSFORO. (2016). Recuperado de cameochemicals: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). ÁCIDO FÓSFORO. Recuperado de chemspider: chemspider.com.
- Por que o ácido fosforoso é diprótico e não triprótico? (2016, 11 de março). Recuperado da química.stackexchange.
- Zumdahl, S. S. (2018, 15 de agosto). Oxiácido. Recuperado da britannica.com.



Ainda sem comentários