
Estrutura, propriedades, síntese e usos do ácido nítrico (HNO3)
O Ácido nítrico É um composto inorgânico que consiste em um oxoácido de nitrogênio. É considerado um ácido forte, embora seu pKa (-1,4) seja semelhante ao pKa do íon hidrônio (-1,74). Deste ponto em diante, é talvez o "mais fraco" de muitos ácidos fortes conhecidos..
Sua aparência física consiste em um líquido incolor que ao ser armazenado muda para uma cor amarelada, devido à formação de gases nitrogênio. Sua fórmula química é HNO3.

É um pouco instável, em ligeira decomposição devido à exposição ao sol. Além disso, pode ser completamente decomposto pelo aquecimento, dando origem a dióxido de nitrogênio, água e oxigênio..
A imagem acima mostra um pouco de ácido nítrico contido em um frasco volumétrico. Nota-se sua coloração amarela, indicativa de decomposição parcial..
É utilizado na fabricação de nitratos inorgânicos e orgânicos, bem como em compostos nitrosos que são utilizados na fabricação de fertilizantes, explosivos, agentes intermediários para tinturas e diversos compostos químicos orgânicos..
Esse ácido já era conhecido pelos alquimistas do século VIII, que eles chamavam de “agua fortis”. O químico alemão Johan Rudolf Glauber (1648) desenhou um método para sua preparação, que consistia em aquecer nitrato de potássio com ácido sulfúrico..
É preparado industrialmente seguindo o método de Wilhelm Oswald (1901). O método, em geral, consiste na oxidação catalítica do amônio, com a geração sucessiva de óxido nítrico e dióxido de nitrogênio para formar ácido nítrico..
Na atmosfera, NÃOdois produzido pela atividade humana reage com a água da nuvem, formando HNO3. Depois, durante as chuvas ácidas, precipita-se junto com gotas d'água, corroendo, por exemplo, estátuas em praças públicas..
O ácido nítrico é um composto muito tóxico e a exposição contínua aos seus vapores pode causar bronquite crônica e pneumonia química..
Índice do artigo
- 1 Estrutura do ácido nítrico
- 1.1 Estruturas de ressonância
- 2 Propriedades físicas e químicas
- 2.1 Nomes químicos
- 2.2 Peso molecular
- 2.3 Aparência física
- 2.4 Odor
- 2,5 ponto de ebulição
- 2.6 Ponto de fusão
- 2.7 Solubilidade em água
- 2.8 Densidade
- 2,9 Densidade relativa
- 2.10 Densidade relativa do vapor
- 2.11 Pressão de vapor
- 2.12 Decomposição
- 2,13 Viscosidade
- 2.14 Corrosão
- 2.15 Entalpia molar de vaporização
- 2.16 Entalpia molar padrão
- 2.17 Entropia molar padrão
- 2.18 Tensão superficial
- 2,19 Limite de odor
- 2.20 Constante de dissociação
- 2,21 Índice de refração (η / D)
- 2.22 Reações químicas
- 3 Síntese
- 3.1 Industrial
- 3.2 No laboratório
- 4 usos
- 4.1 Produção de fertilizantes
- 4.2 Industrial
- 4.3 Purificador de Metal
- 4.4 Aqua regia
- 4.5 Móveis
- 4.6 Limpeza
- 4.7 Fotografia
- 4.8 Outros
- 5 Toxicidade
- 6 referências
Estrutura do ácido nítrico
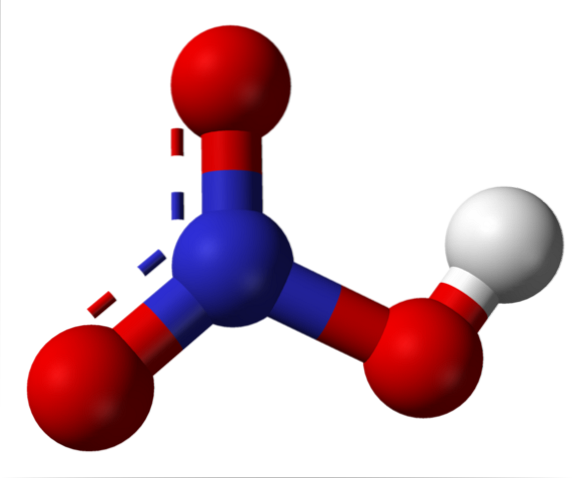
A imagem superior mostra a estrutura de uma molécula de HNO.3 com um modelo de esferas e barras. O átomo de nitrogênio, a esfera azul, está localizado no centro, rodeado por uma geometria plana trigonal; no entanto, o triângulo é distorcido por um de seus vértices mais longos.
As moléculas de ácido nítrico são então planas. As ligações N = O, N-O e N-OH constituem os vértices do triângulo plano. Se observada em detalhes, a ligação N-OH é mais alongada do que as outras duas (onde a esfera branca que representa o átomo H é encontrada).
Estruturas de ressonância
Existem duas ligações com o mesmo comprimento: N = O e N-O. Esse fato vai contra a teoria das ligações de valência, em que as ligações duplas são mais curtas do que as ligações simples. A explicação para isso está no fenômeno da ressonância, conforme pode ser visto na imagem abaixo.

Ambas as ligações, N = O e N-O, são, portanto, equivalentes em termos de ressonância. Isso é representado graficamente no modelo de estrutura usando uma linha tracejada entre dois átomos de O (ver estrutura).
Quando HNO é desprotonado3, o nitrato de ânion estável NO é formado3-. Nele, a ressonância agora envolve todos os três átomos de O. Esta é a razão pela qual HNO3 tem alta acidez de Bronsted-Lowry (espécie doadora de íons H+).
Propriedades físicas e químicas
Nomes químicos
-Ácido nítrico
-Ácido azótico
-Nitrato de hidrogênio
-Água Fortis.
Peso molecular
63,012 g / mol.
Aspecto físico
Líquido incolor ou amarelo claro, que pode virar marrom avermelhado.
Odor
Característica pungente e sufocante.
Ponto de ebulição
181ºF a 760mmHg (83ºC).
Ponto de fusão
-41,6 ºC.
Solubilidade em água
Muito solúvel e miscível com água.
Densidade
1,513 g / cm3 a 20 ºC.
Densidade relativa
1,50 (em relação à água = 1).
Densidade relativa do vapor
2 ou 3 vezes estimado (em relação ao ar = 1).
Pressão de vapor
63,1 mmHg a 25 ºC.
Decomposição
Por exposição à umidade atmosférica ou ao calor, pode se decompor para formar peróxido de nitrogênio. Quando aquecido até a decomposição, ele emite uma fumaça muito tóxica de óxido de nitrogênio e nitrato de hidrogênio..
O ácido nítrico não é estável, podendo se decompor em contato com o calor e exposição à luz solar, emitindo dióxido de nitrogênio, oxigênio e água..
Viscosidade
1.092 mPa a 0 ° C e 0,617 mPa a 40 ° C.
Corrosão
É capaz de atacar todos os metais básicos, exceto alumínio e aço crômico. Ataca algumas variedades de plásticos, borrachas e revestimentos. É uma substância cáustica e corrosiva, por isso deve ser manuseada com extremo cuidado.
Entalpia molar de vaporização
39,1 kJ / mol a 25 ºC.
Entalpia molar padrão
-207 kJ / mol (298 ºF).
Entropia molar padrão
146 kJ / mol (298 ºF).
Tensão superficial
-0,04356 N / m a 0 ºC
-0,04115 N / m a 20 ºC
-0,0376 N / m a 40 ºC
Limiar de odor
-Baixo odor: 0,75 mg / m3
-Alto odor: 250 mg / m3
-Concentração irritante: 155 mg / m3.
Constante de dissociação
pKa = -1,38.
Índice de refração (η / D)
1,393 (16,5 ºC).
Reações químicas
Hidratação
-Pode formar hidratos sólidos, como HNO3∙ HdoisO e HNO3∙ 3HdoisOu: "gelo nítrico".
Dissociação em água
O ácido nítrico é um ácido forte que se ioniza rapidamente na água da seguinte forma:
HNO3 (l) + HdoisO (l) => H3OU+ (ac) + NÃO3-
Formação de sal
Reage com óxidos básicos para formar um sal de nitrato e água.
CaO (s) + 2 HNO3 (l) => Ca (NÃO3)dois (ac) + HdoisO (l)
Da mesma forma, reage com bases (hidróxidos), formando um sal de nitrato e água..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HdoisO (l)
E também com carbonatos e carbonatos ácidos (bicarbonatos), formando também dióxido de carbono.
N / DdoisCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HdoisO (l) + COdois (g)
Protonação
O ácido nítrico também pode se comportar como uma base. Por esse motivo, pode reagir com ácido sulfúrico.
HNO3 + 2hdoisSW4 <=> NÃOdois+ + H3OU+ + 2HSO4-
Autoprotólise
O ácido nítrico sofre autoprotólise.
2HNO3 <=> NÃOdois+ + NÃO3- + HdoisOU
Oxidação de metal
Na reação com metais, o ácido nítrico não se comporta como ácidos fortes, que reagem com os metais, formando o sal correspondente e liberando hidrogênio na forma gasosa..
No entanto, o magnésio e o manganês reagem quentes com o ácido nítrico, assim como os outros ácidos fortes..
Mg (s) + 2 HNO3 (l) => Mg (NO3)dois (ac) + Hdois (g)
Outro
O ácido nítrico reage com os sulfitos metálicos para formar um sal nitrato, dióxido de enxofre e água..
N / DdoisSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOdois (g) + HdoisO (l)
E também reage com compostos orgânicos, substituindo um hidrogênio por um grupo nitro; constituindo assim a base para a síntese de compostos explosivos, como nitroglicerina e trinitrotolueno (TNT).
Síntese
Industrial
É produzido em nível industrial através da oxidação catalítica do amônio, de acordo com o método descrito por Oswald em 1901. O procedimento consiste em três etapas ou etapas.
Estágio 1: Oxidação de Amônio em Óxido Nítrico
A amônia é oxidada pelo oxigênio do ar. A reação é realizada a 800ºC e a uma pressão de 6-7 atm, com o uso de platina como catalisador. A amônia é misturada com o ar com a seguinte proporção: 1 volume de amônia por 8 volumes de ar.
4NH3 (g) + 5Odois (g) => 4NO (g) + 6HdoisO (l)
O óxido nítrico é produzido na reação, que é levado à câmara de oxidação para a próxima etapa..
Estágio 2. Oxidação de óxido nítrico em dióxido de nitrogênio
A oxidação é realizada pelo oxigênio presente no ar a uma temperatura abaixo de 100 ºC.
2NO (g) + Odois (g) => 2NOdois (g)
Fase 3. Dissolução do dióxido de nitrogênio na água
Nesta fase ocorre a formação de ácido nítrico.
4NOdois + 2hdoisO + Odois => 4HNO3
Existem vários métodos para a absorção de dióxido de nitrogênio (NOdois) na água.
Entre outros métodos: NÃOdois é dimerizado para NdoisOU4 em baixas temperaturas e alta pressão, a fim de aumentar sua solubilidade em água e produzir ácido nítrico.
3NdoisOU4 + 2hdoisO => 4HNO3 + 2NO
O ácido nítrico produzido pela oxidação da amônia tem uma concentração entre 50-70%, que pode ser levada a 98% usando o ácido sulfúrico concentrado como desidratante, permitindo aumentar a concentração do ácido nítrico..
No laboratório
Decomposição térmica do nitrato de cobre (II), produzindo dióxido de nitrogênio e gases oxigênio, que passam pela água para formar ácido nítrico; como no método Oswald, anteriormente descrito.
2Cu (NÃO3)dois => 2CuO + 4NOdois + OUdois
Reação de um sal nitrato com HdoisSW4 concentrado. O ácido nítrico formado é separado do HdoisSW4 por destilação a 83 ºC (ponto de ebulição do ácido nítrico).
KNO3 + HdoisSW4 => HNO3 + KHSO4
Formulários
Produção de fertilizantes
60% da produção de ácido nítrico é utilizada na fabricação de fertilizantes, principalmente nitrato de amônio.
Esta é caracterizada por sua alta concentração de nitrogênio, um dos três principais nutrientes das plantas, nitrato sendo utilizado imediatamente pelas plantas. Enquanto isso, a amônia é oxidada pelos microrganismos presentes no solo e é usada como fertilizante de longo prazo..
Industrial
-15% da produção de ácido nítrico é usado na fabricação de fibras sintéticas.
-É utilizado na produção de ésteres de ácido nítrico e derivados nitro; tais como nitrocelulose, tintas acrílicas, nitrobenzeno, nitrotolueno, acrilonitrilos, etc..
-Pode adicionar grupos nitro a compostos orgânicos, e essa propriedade pode ser usada para fazer explosivos como nitroglicerina e trinitrotolueno (TNT)..
-O ácido adípico, um precursor do náilon, é produzido em grande escala pela oxidação da ciclohexanona e do ciclohexanol pelo ácido nítrico..
Purificador de metal
O ácido nítrico, devido à sua capacidade oxidante, é muito útil na purificação de metais presentes nos minerais. Da mesma forma, é utilizado na obtenção de elementos como urânio, manganês, nióbio, zircônio e na acidificação de rochas fosfóricas para obtenção de ácido fosfórico..
Água real
É misturado com ácido clorídrico concentrado para formar "água régia". Esta solução é capaz de dissolver ouro e platina, o que permite seu uso na purificação desses metais..
Mobília
O ácido nítrico é usado para obter um efeito antigo em móveis de madeira de pinho. O tratamento com solução de ácido nítrico a 10% produz uma coloração cinza-ouro na madeira dos móveis.
Limpeza
-A mistura de soluções aquosas de ácido nítrico 5-30% e ácido fosfórico 15-40% é utilizada na limpeza do equipamento utilizado no trabalho de ordenha, a fim de eliminar os resíduos dos precipitados dos compostos de magnésio e cálcio.
-É útil na limpeza de vidros usados em laboratório.
Fotografia
-O ácido nítrico tem sido usado em fotografia, especificamente como um aditivo para reveladores de sulfato ferroso no processo de placa úmida, a fim de promover uma cor mais branca em ambrótipos e estanho..
-Foi utilizado para diminuir o pH do banho de prata das placas de colódio, o que permitiu obter uma redução no aparecimento de uma névoa que interferia nas imagens..
Outras
-Devido à sua capacidade solvente, é utilizado na análise de diferentes metais por técnicas de espectrofotometria de absorção atômica com chama e espectrofotometria de massa com plasma indutivamente acoplado..
-A combinação de ácido nítrico e ácido sulfúrico foi usada para a conversão do algodão comum em nitrato de celulose (algodão nítrico).
-O medicamento Salcoderm para uso externo é utilizado no tratamento de neoplasias benignas da pele (verrugas, calosidades, condilomas e papilomas). Possui propriedades de cauterização, alívio da dor, irritação e coceira. O ácido nítrico é o principal componente da fórmula do medicamento.
-O ácido nítrico fumante vermelho e ácido nítrico fumante branco são usados como oxidantes para combustíveis líquidos para foguetes, especialmente no míssil BOMARC..
Toxicidade
-Em contato com a pele, pode causar queimaduras na pele, dores intensas e dermatites..
-Em contato com os olhos, pode causar fortes dores, lacrimejamento e, em casos graves, danos à córnea e cegueira..
-A inalação dos vapores pode causar tosse, dificuldade respiratória, sangramento nasal, laringite, bronquite crônica, pneumonia e edema pulmonar em exposições graves ou crônicas..
-Devido à sua ingestão, ocorrem lesões na boca, salivação, sede intensa, dores ao engolir, dores intensas em todo o trato digestivo e risco de perfuração da parede do mesmo..
Referências
- Wikipedia. (2018). Ácido nítrico. Recuperado de: en.wikipedia.org
- PubChem. (2018). Ácido nítrico. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Os editores da Encyclopaedia Britannica. (23 de novembro de 2018). Ácido nítrico. Encyclopædia Britannica. Recuperado de: britannica.com
- Shrestha B. (s.f.). Propriedades do ácido nítrico e utilizações. Guia de química: tutoriais para o aprendizado de química. Recuperado de: chem-guide.blogspot.com
- Livro Químico. (2017). Ácido nítrico. Recuperado de: chemicalbook.com
- Imanol. (10 de setembro de 2013). Produção de ácido nítrico. Recuperado de: ingenieriaquimica.net



Ainda sem comentários