
Estrutura, síntese, propriedades e usos do ácido pícrico
O Ácido Pícrico é um composto químico orgânico altamente nitrado cujo nome IUPAC é 2,4,6-trinitrofenol. Sua fórmula molecular é C6Hdois(NÃOdois)3OH. É um fenol muito ácido e pode ser encontrado como picrato de sódio, amônio ou potássio; ou seja, em sua forma iônica C6Hdois(NÃOdois)3Com um.
É um sólido de forte sabor amargo, de onde deriva seu nome, da palavra grega 'prikos', que significa amargo. É encontrado na forma de cristais amarelos úmidos. Sua dessecação ou desidratação é perigosa, pois aumenta as propriedades instáveis que o tornam explosivo.
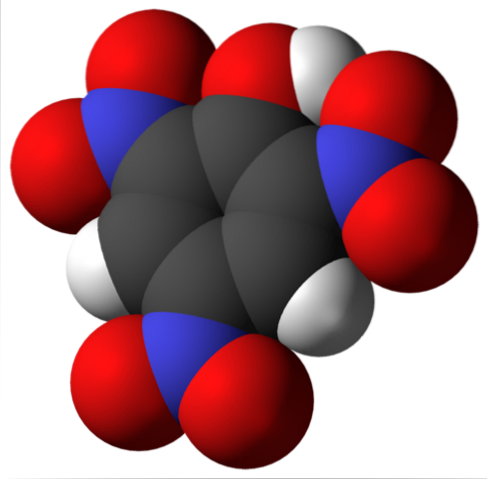
A molécula de ácido pícrico é mostrada acima. Na imagem é difícil reconhecer as ligações e os átomos porque isso corresponde à representação de sua superfície de Van der Waals. A próxima seção aborda a estrutura molecular em mais detalhes..
Alguns compostos intermediários, vários sais de picrato e complexos de ácido pícrico são sintetizados a partir do ácido pícrico..
O ácido pícrico é usado como base para a síntese de corantes amarelos permanentes. Alguns patologistas e pesquisadores usam na fixação ou coloração de seções de tecido e outros processos imunohistoquímicos..
É muito útil na fabricação de produtos farmacêuticos. Além disso, é utilizado na produção de fósforos e explosivos. Também é usado para gravar metais, fazer vidros coloridos e na determinação colorimétrica de parâmetros biológicos como a creatinina..
Por outro lado, o ácido pícrico é irritante quando entra em contato com a pele, mucosa respiratória, ocular e digestiva. Além de danificar a pele, pode afetar gravemente os rins, o sangue e o fígado, entre outros órgãos..
Índice do artigo
- 1 Estrutura
- 1.1 Fenol ácido
- 1.2 Estrutura de cristal
- 2 Síntese
- 2.1 Nitração direta de fenol
- 3 Propriedades físicas e químicas
- 3.1 Peso molecular
- 3.2 Aparência física
- 3,3 Odor
- 3.4 Sabor
- 3.5 Ponto de fusão
- 3.6 Ponto de ebulição
- 3.7 Densidade
- 3.8 Solubilidade
- 3.9 Corrosividade
- 3,10 pKa
- 3.11 Instabilidade
- 4 usos
- 4.1 Pesquisa
- 4.2 Química Orgânica
- 4.3 Na indústria
- 4.4 Aplicações militares
- 5 Toxicidade
- 6 referências
Estrutura

A imagem superior mostra todas as ligações e a própria estrutura da molécula de ácido pícrico em maiores detalhes. Consiste em um fenol com três substituintes nitro.
Percebe-se que nos grupos NÃOdois o átomo de nitrogênio tem carga parcial positiva e, portanto, exige a densidade eletrônica de seu entorno. Mas, o anel aromático também atrai elétrons para si, e antes dos três NÃOdois acaba abrindo mão de parte de sua própria densidade eletrônica.
Em conseqüência disso, o oxigênio do grupo OH tende mais a compartilhar um de seus pares eletrônicos livres para suprir a deficiência eletrônica sofrida pelo anel; e ao fazer isso, a ligação C = O é formada+-H. Esta carga positiva parcial no oxigênio enfraquece a ligação O-H e aumenta a acidez; ou seja, ele será liberado como um íon de hidrogênio, H+.
Fenol ácido
É por essa razão que esse composto é um ácido excepcionalmente forte (e reativo), ainda mais do que o próprio ácido acético. No entanto, o composto é na verdade um fenol cuja acidez supera a dos outros fenóis; devido, como mencionado, aos substituintes NOdois.
Portanto, por ser um fenol, o grupo OH tem prioridade e direciona a enumeração na estrutura. Os três NÃOdois eles estão localizados nos carbonos 2, 4 e 6 do anel aromático em relação ao OH. É aqui que a nomenclatura IUPAC para este composto é derivada: 2,4,6-Trinitrofenol (TNP).
Se os grupos não estivessem lá, NÃOdois, ou se houvesse um número menor deles no anel, a ligação O-H enfraqueceria menos e, portanto, o composto teria menos acidez.
Estrutura de cristal
As moléculas de ácido pícrico são organizadas de maneira que favoreçam suas interações intermoleculares; seja para a formação de ligações de hidrogênio entre os grupos OH e NOdois, forças dipolo-dipolo, ou repulsões eletrostáticas entre regiões deficientes de elétrons.
Pode-se esperar que os grupos NÃOdois eles se repeliam e se orientavam na direção dos anéis aromáticos vizinhos. Além disso, os anéis não seriam capazes de se alinhar um sobre o outro devido ao aumento das repulsões eletrostáticas..
Produto de todas essas interações, o ácido pícrico consegue formar uma rede tridimensional que define um cristal; cuja célula unitária corresponde a um sistema cristalino do tipo ortorrômbico.
Síntese
Inicialmente, foi sintetizado a partir de compostos naturais como derivados de chifres de animais, resinas naturais, entre outros. A partir de 1841, o fenol tem sido usado como um precursor do ácido pícrico, seguindo várias rotas ou através de vários procedimentos químicos.
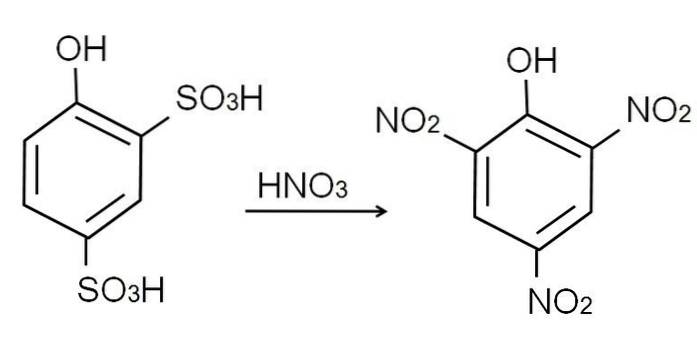
Como já mencionado, é um dos fenóis mais ácidos. Para sintetizá-lo, o fenol primeiro passa por um processo de sulfonação, seguido por um processo de nitração..
A sulfonação do fenol anidro é realizada tratando o fenol com ácido sulfúrico fumante, produzindo substituições eletrofílicas aromáticas de H por grupos sulfonato, SO3H, na posição -orto e -para em relação ao grupo OH.
Este produto, ácido 2,4-fenoldissulfônico, passa pelo processo de nitração, tratando-o com ácido nítrico concentrado. Ao fazer isso, os dois grupos SO3H são substituídos por grupos nitro, NÃOdois, e um terceiro entra na outra posição nitro. A seguinte equação química ilustra isso:
Nitração direta de fenol
O processo de nitração de fenol não pode ser realizado diretamente, pois são gerados alcatrões de alto peso molecular. Este método de síntese requer um controle muito cuidadoso da temperatura, pois é muito exotérmico:
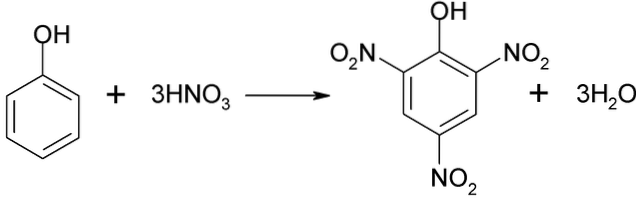
O ácido pícrico pode ser obtido por meio do processo de nitração direta do 2,4-dinitrofenol, com ácido nítrico.
Outra forma de síntese é o tratamento do benzeno com ácido nítrico e nitrato mercúrico..
Propriedades físicas e químicas
Peso molecular
229,104 g / mol.
Aparência física
Massa amarela ou suspensão de cristais úmidos.
Odor
É inodoro.
Gosto
É muito amargo.
Ponto de fusão
122,5 ° C.
Ponto de ebulição
300 ° C Mas, quando derretido, ele explode.
Densidade
1,77 g / mL.
Solubilidade
É um composto moderadamente solúvel em água. Isso ocorre porque seus grupos OH e NOdois eles podem interagir com moléculas de água por meio de ligações de hidrogênio; embora o anel aromático seja hidrofóbico e, portanto, prejudique sua solubilidade.
Corrosividade
O ácido pícrico é geralmente corrosivo para metais, exceto estanho e alumínio.
pKa
0,38. É um ácido orgânico forte.
Instabilidade
O ácido pícrico é caracterizado por propriedades instáveis. Constitui um risco para o meio ambiente, é instável, explosivo e tóxico.
Deve ser armazenado bem fechado para evitar a desidratação, uma vez que o ácido pícrico é muito explosivo se secar. Muito cuidado deve ser tomado com sua forma anidra, pois é muito sensível ao atrito, choque e calor..
O ácido pícrico deve ser armazenado em locais frescos e ventilados, longe de materiais oxidáveis. É irritante em contato com a pele e membranas mucosas, não deve ser ingerido e é tóxico para o corpo.
Formulários
O ácido pícrico tem sido amplamente utilizado em pesquisas, química, indústria e militares..
Investigação
Quando usado como fixador de células e tecidos, melhora os resultados da coloração com corantes ácidos. Isso acontece com métodos de coloração tricrômicos. Após a fixação do tecido com formalina, uma nova fixação com ácido pícrico é recomendada..
Desta forma, é garantida uma coloração intensa e muito viva dos tecidos. Você não obtém bons resultados com corantes básicos. No entanto, deve-se tomar precauções, pois o ácido pícrico pode hidrolisar o DNA se deixado por muito tempo..
Quimica Organica
-Em química orgânica, é usado como picratos alcalinos para realizar a identificação e análise de várias substâncias.
-É usado em química analítica de metais.
-Em laboratórios clínicos, é usado na determinação dos níveis de creatinina sérica e urinária..
-Também tem sido usado em alguns dos reagentes usados para a análise dos níveis de glicose..
Na indústria
-No nível da indústria fotográfica, o ácido pícrico tem sido usado como um sensibilizador em emulsões fotográficas. Tem feito parte da produção de produtos como agrotóxicos, inseticidas fortes, entre outros.
-O ácido pícrico é usado para sintetizar outros intermediários químicos como cloropicrina e ácido picrâmico, por exemplo. Alguns medicamentos e tintas para a indústria do couro têm sido feitos a partir desses compostos..
-O ácido pícrico passou a ser utilizado no tratamento de queimaduras, como anti-séptico e outras condições, antes que sua toxicidade se tornasse evidente.
-Componente importante devido à sua natureza explosiva na fabricação de fósforos e baterias.
Aplicações militares
-Devido à alta explosividade do ácido pícrico, ele tem sido usado em fábricas de munição para armas militares.
-O ácido pícrico prensado e fundido tem sido usado em projéteis de artilharia, granadas, bombas e minas.
-O sal de amônio do ácido pícrico tem sido usado como explosivo, é muito poderoso, mas menos estável do que o TNT. Por um tempo, foi usado como um componente de combustível de foguete.
Toxicidade
Está provado que é muito tóxico para o corpo humano e em geral para todos os seres vivos.
Recomenda-se evitar inalação e ingestão, devido à sua toxicidade oral aguda. Também causa mutação em microrganismos. Tem efeitos tóxicos na vida selvagem, mamíferos e meio ambiente em geral.
Referências
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10º edição.). Wiley plus.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Wikipedia. (2018). Ácido Pícrico. Recuperado de: en.wikipedia.org
- Universidade de Purdue. (2004). Explosão de ácido pícrico. Recuperado de: chemed.chem.purdue.edu
- Projeto de Cristalografia 365. (10 de fevereiro de 2014). Menos do que amarelo suave - a estrutura do ácido pícrico. Recuperado de: crystallography365.wordpress.com
- PubChem. (2019). Ácido Pícrico. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Ácido Pícrico. Methuen, Londres, Reino Unido.



Ainda sem comentários