
Fórmula de ácido perclórico, características e usos

O ácido perclórico É um ácido mineral muito forte, geralmente encontrado como uma solução aquosa incolor e inodora, corrosiva para metais e tecidos. É um oxidante poderoso quando quente, mas suas soluções aquosas (até cerca de 70% por peso) em temperatura ambiente são geralmente seguras, apresentando apenas características ácidas fortes e nenhuma propriedade oxidante..
Ácido perclórico e seus sais (particularmente perclorato de amônio [NH4ClO4, CAS: 7790-98-9], perclorato de sódio [NaClO4, 7601-89-0], e perclorato de potássio [KClO4, 7778-74- 7]), encontram muitas aplicações devido ao seu forte poder oxidante.

Sua produção tem aumentado devido ao seu uso como matéria-prima para a produção de perclorato de amônio puro, ingrediente básico em explosivos e propelentes sólidos para foguetes e mísseis..

O ácido perclórico também é usado, em escala limitada, como reagente para fins analíticos. Seus recipientes fechados podem se romper violentamente sob exposição prolongada ao calor..
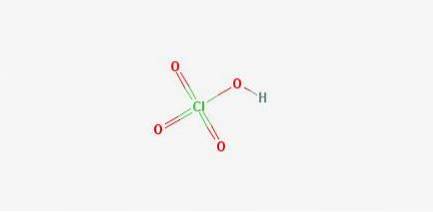
Fórmulas: Ácido perclórico: HClO4
CAS: 7601-90-3
Estrutura 2D
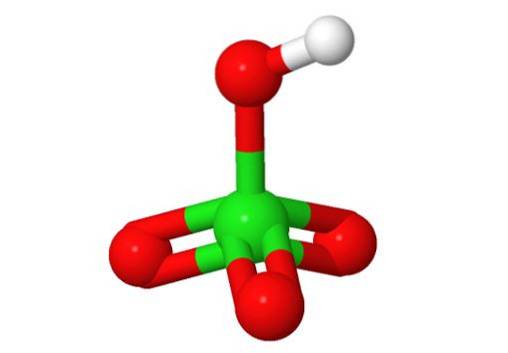
Estrutura 3D
Características do ácido perclórico
Propriedades físicas e químicas
- Aparência: líquido incolor
- Odor: inodoro
- Peso molecular: 100,454 g / mol
- Ponto de ebulição: 19 ° C
- Ponto de fusão: -112 ° C
- Densidade: 1,768 g / cm3
- Solubilidade em água: Miscível
- Acidez (pKa): -15,2 (± 2,0)
O ácido perclórico pertence ao grupo dos ácidos oxidantes fortes.
Inflamabilidade
-Os ácidos oxidantes fortes geralmente não são inflamáveis, mas podem acelerar a combustão de outros materiais, fornecendo oxigênio (atuando como agentes oxidantes).
-Soluções de ácido perclórico podem explodir com o calor ou contaminação.
-Quando aquecidos acima de 160 ° C, ou envolvidos em um incêndio, eles podem se decompor explosivamente.
-Eles podem reagir explosivamente com hidrocarbonetos (combustíveis). Pode inflamar combustíveis (madeira, papel, óleo, roupas, etc.).
-Os recipientes podem explodir quando aquecidos.
-O escoamento pode criar risco de incêndio ou explosão.
Reatividade
-Os ácidos oxidantes fortes são geralmente solúveis em água com a liberação de íons de hidrogênio. As soluções resultantes têm um pH de 1 ou próximo a 1.
-Os materiais deste grupo reagem com bases químicas (por exemplo, aminas e hidróxidos inorgânicos) para formar sais. Essas reações de neutralização ocorrem quando a base aceita íons de hidrogênio que o ácido doa.
-As neutralizações podem gerar quantidades perigosamente grandes de calor em pequenos espaços.
-A adição de água aos ácidos geralmente gera calor suficiente na pequena região da mistura para ferver essa parte da água de forma explosiva, o que pode levar a salpicos de ácido muito perigosos..
-Esses materiais têm uma capacidade significativa como agentes oxidantes, mas essa capacidade varia de um para outro..
-Eles podem reagir com metais ativos (como ferro e alumínio) e também com muitos metais menos ativos, para dissolver o metal e liberar hidrogênio e / ou gases tóxicos.
-Suas reações com sais de cianeto e seus compostos liberam cianeto de hidrogênio gasoso..
-Gases inflamáveis e / ou tóxicos também são gerados por suas reações com ditiocarbamatos, isocianatos, mercaptanos, nitretos, nitrilos, sulfetos e agentes redutores fracos ou fortes..
-Outras reações geradoras de gás ocorrem com sulfitos, nitritos, tiossulfatos (para dar H2S e SO3), ditionitos (SO2) e até carbonatos: o gás dióxido de carbono deste último não é tóxico, mas o calor e respingos da reação podem ser perturbados.
-As soluções de ácido perclórico são soluções de ácido oxidante forte.
-Podem reagir vigorosamente ou detonar, quando misturados com materiais oxidáveis (álcoois, aminas, boranos, dicianogênios, hidrazinas, hidrocarbonetos, hidrogênio, nitroalcanos, metais em pó, silanos e tióis, entre outros).
-O ácido perclórico inflama em contato com cloreto de sulfinila.
Toxicidade
-Ácidos oxidantes fortes são corrosivos para os tecidos. Os vapores de ácido irritam os tecidos sensíveis (como olhos e sistema respiratório) gravemente.
-A inalação, ingestão ou contato (da pele, olhos, etc.) com soluções de ácido perclórico ou seus vapores pode causar ferimentos graves, queimaduras ou morte..
-Quando entram em contato com o fogo, podem produzir gases irritantes, corrosivos e / ou tóxicos..
-O escoamento do controle de fogo ou água de diluição pode causar contaminação.
Formulários
-O ácido perclórico é utilizado nas áreas de pesquisa e desenvolvimento científico e na fabricação de produtos químicos e equipamentos elétricos, eletrônicos e ópticos.
-É usado como precursor na produção de perclorato de amônio puro, ingrediente básico em explosivos e propelentes sólidos para foguetes e mísseis..
-Os usos do ácido perclórico em casa incluem limpadores de banheiros, metais e ralos, removedores de ferrugem, em baterias e como primer para unhas postiças..
-Os usos industriais incluem: refino de metal, encanamento, branqueamento, corrosão, galvanoplastia, fotografia, desinfecção, munição, fabricação de fertilizantes, limpeza de metal e remoção de ferrugem.
-O ácido perclórico também é usado, em escala limitada, como reagente para fins analíticos..
Efeitos clínicos
Os ácidos causam necrose de coagulação. Os íons hidrogênio dessecam as células epiteliais, causando edema, eritema, descamação de tecido e necrose, com formação de úlceras e escaras..
Na exposição a esses ácidos por via gastrointestinal, os pacientes podem desenvolver queimaduras de grau II (bolhas superficiais, erosões e ulcerações) que correm o risco de formação de estenose subsequente, particularmente na via gástrica e no esôfago..
Também podem ocorrer queimaduras profundas e necrose da mucosa gastrointestinal. As complicações geralmente incluem perfuração (esofágica, gástrica, raramente duodenal), formação de fístula (traqueoesofágica, aortoesofágica) e sangramento gastrointestinal..
A exposição por inalação pode causar dispneia, dor torácica pleurítica, tosse e broncoespasmo, edema respiratório superior e queimaduras. Edema respiratório superior é comum e muitas vezes ameaça a vida.
A exposição dos olhos pode causar irritação conjuntival severa e quemose, defeitos epiteliais da córnea, isquemia límbica, perda permanente da visão e em casos graves de perfuração..
A exposição cutânea leve pode causar irritação e queimaduras de espessura parcial. A exposição mais longa ou de alta concentração pode causar queimaduras de espessura total.
As complicações podem incluir celulite, sepse, contraturas, osteomielite e toxicidade sistêmica.
Segurança e riscos
Declarações de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (GHS)
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema internacionalmente aceito, criado pelas Nações Unidas e projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países, usando critérios consistentes globalmente..
As classes de perigo (e seu capítulo GHS correspondente), padrões de classificação e rotulagem e recomendações para ácido perclórico são as seguintes (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Declarações de perigo GHS
H271: Pode causar incêndio ou explosão; Oxidante forte [Perigo Líquidos oxidantes; Sólidos oxidantes - Categoria 1] (PubChem, 2017).
H290: Pode ser corrosivo para metais [Advertência Corrosivo para Metais - Categoria 1] (PubChem, 2017).
H302: Nocivo por ingestão [Aviso Toxicidade aguda, oral - Categoria 4] (PubChem, 2017).
H314: Provoca queimaduras na pele e lesões oculares graves [Perigo corrosão / irritação cutânea - Categoria 1A, B, C] (PubChem, 2017).
H318: Causa lesões oculares graves [Perigo Lesões oculares graves / irritação ocular - Categoria 1] (PubChem, 2017).
H371: Pode causar danos a órgãos [Advertência, toxicidade para órgãos-alvo específicos, exposição única - Categoria 2] (PubChem, 2017).
Códigos de instruções de cuidado
P210, P220, P221, P234, P260, P264, P270, P280, P283, P301 + P312, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P306 + P360, P309 + P311, P310, P321, P330, P363, P370 + P378, P371 + P380 + P375, P390, P404, P405 e P501 (PubChem, 2017).





Referências
- Agência Europeia dos Produtos Químicos (ECHA). (2016). Ácido perclórico. Breve Perfil. Retirado em 8 de fevereiro de 2017, de: echa.europa.eu.
- JSmol (2017) Ácido perclórico. [imagem] Recuperado de: chemapps.stolaf.edu.
- NASA (2008) Ares-1, lançamento 02-2008 [imagem] Recuperado de: commons.wikimedia.org.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2017). Ácido perclórico - Estrutura PubChem. [imagem] Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Oelen, W. (2011) Ácido perclórico 60 por cento [imagem] Recuperado de: en.wikipedia.org.
- Wikipedia. (2017). Ácido perclórico. Recuperado em 8 de fevereiro de 2017, em: es.wikipedia.org.
- Wikipedia. (2017). Ácido perclórico. Recuperado em 8 de fevereiro de 2017, em: es.wikipedia.org.

Ainda sem comentários