
Estrutura, propriedades e usos do seleneto de hidrogênio (H2Se)

O hidrogênio selênio ou seleneto de hidrogênio é um composto inorgânico cuja fórmula química é HdoisEu sei. É covalente por natureza e, em condições normais de temperatura e pressão, é um gás incolor; mas com um cheiro forte reconhecível por sua presença menor. Quimicamente, é um calcogeneto, então o selênio tem uma valência de -2 (Sedois-).
De todos os selenetos, o HdoisÉ o mais tóxico porque sua molécula é pequena e seu átomo de selênio tem menos impedimento estérico ao reagir. Por outro lado, seu odor permite que quem o trabalha com ele detecte na hora em caso de vazamento fora do exaustor do laboratório..
O seleneto de hidrogênio pode ser sintetizado pela combinação direta de seus dois elementos: hidrogênio molecular, Hdois, e selênio metálico. Também pode ser obtido dissolvendo compostos ricos em selênio, como o seleneto de ferro (II), FeSe, em ácido clorídrico..
Por outro lado, o seleneto de hidrogênio é preparado pela dissolução do seleneto de hidrogênio em água; ou seja, o primeiro é dissolvido em água, enquanto o segundo consiste em moléculas gasosas.
Seu principal uso é ser fonte de selênio em síntese orgânica e inorgânica.
Índice do artigo
- 1 Estrutura do seleneto de hidrogênio
- 2 propriedades
- 2.1 Aparência física
- 2.2 Massa molecular
- 2.3 Ponto de ebulição
- 2.4 Ponto de fusão
- 2,5 pressão de vapor
- 2.6 Densidade
- 2,7 pKa
- 2.8 Solubilidade em água
- 2.9 Solubilidade em outros solventes
- 3 Nomenclatura
- 3.1 Seleneto ou hidreto?
- 4 usos
- 4.1 Metabólico
- 4.2 Industrial
- 5 referências
Estrutura do seleneto de hidrogênio
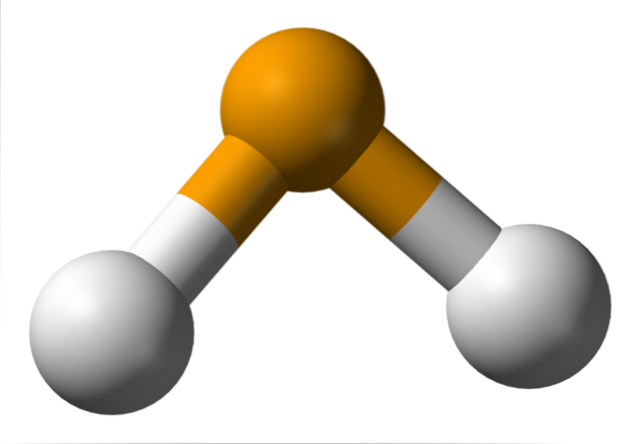
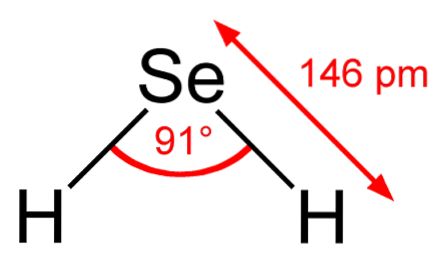
Na imagem superior observa-se que a molécula de HdoisÉ de geometria angular, embora seu ângulo de 91 ° faça com que pareça mais com um L do que com um V. Neste modelo de esferas e hastes, os átomos de hidrogênio e selênio são as esferas branca e amarela, respectivamente..
Esta molécula, como mostrado, é a que está na fase gasosa; isto é, para o seleneto de hidrogênio. Quando dissolvido em água, ele libera um próton e em solução temos o par HSe- H3OU+; este par de íons vem a seleneto de hidrogênio, denotado como HdoisSe (ac) para diferenciá-lo do seleneto de hidrogênio, HdoisSe (g).
Portanto, as estruturas entre o HdoisSe (ac) e HdoisSe (g) são muito diferentes; o primeiro é circundado por uma esfera aquosa e apresenta cargas iônicas, e o segundo consiste em um aglomerado de moléculas em fase gasosa.
Moléculas de HdoisEles mal podem interagir uns com os outros por forças dipolo-dipolo muito fracas. O selênio, embora seja menos eletronegativo do que o enxofre, concentra uma densidade de elétrons mais alta ao "retirá-los" dos átomos de hidrogênio..
Comprimidos de hidretos de selênio
Se as moléculas de HdoisEles são submetidos a uma pressão extraordinária (centenas de GPa), teoricamente são forçados a solidificar através da formação de ligações Se-H-Se; Estas são ligações de três centros e dois elétrons (3c-2e) onde o hidrogênio participa. Portanto, as moléculas começam a formar estruturas poliméricas que definem um sólido..
Nessas condições, o sólido pode ser enriquecido com mais hidrogênio, o que modifica completamente as estruturas resultantes. Além disso, a composição torna-se do tipo HnSe, onde n varia de 3 a 6. Assim, os hidretos de selênio comprimidos por essas pressões, e na presença de hidrogênio, têm as fórmulas químicas H3Se a H6eu sei.
Estima-se que esses hidretos de selênio enriquecidos com hidrogênio tenham propriedades supercondutoras.
Propriedades
Aparência física
Gás incolor que em baixas temperaturas cheira a rabanete podre e ovos podres se sua concentração aumentar. Seu cheiro é pior e mais intenso que o do sulfeto de hidrogênio (que já é bastante desagradável). No entanto, isso é bom, pois facilita sua detecção e reduz os riscos de contato prolongado ou inalação..
Quando queima, emite um produto de chama azulada das interações eletrônicas nos átomos de selênio.
Massa molecular
80,98 g / mol.
Ponto de ebulição
-41 ° C.
Ponto de fusão
-66 ° C.
Pressão de vapor
9,5 atm a 21 ° C.
Densidade
3.553 g / L.
pKpara
3,89.
Solubilidade em água
0,70 g / 100 mL. Isso corrobora o fato de que o átomo de selênio de HdoisNão consegue formar ligações de hidrogênio apreciáveis com moléculas de água.
Solubilidade em outros solventes
-Solúvel em CSdois, o que não é surpreendente por causa da analogia química entre selênio e enxofre.
-Solúvel em fosgênio (em baixas temperaturas, pois ferve a 8 ° C).
Nomenclatura
Como já explicado nas seções anteriores, o nome deste composto varia dependendo se HdoisEstá na fase gasosa ou dissolvido em água. Quando está na água, é referido como seleneto de hidrogênio, que nada mais é do que um hidrácido em termos inorgânicos. Ao contrário das moléculas gasosas, seu caráter ácido é maior.
Porém, seja na forma de gás ou dissolvido em água, o átomo de selênio mantém as mesmas características eletrônicas; por exemplo, sua valência é -2, a menos que sofra uma reação de oxidação. Esta valência de -2 é a razão pela qual é chamada de seleniauroque hidrogênio, uma vez que o ânion seleneto é Sedois-; que é mais reativo e redutor do que Sdois-, sulfureto.
Se nomenclatura sistemática for usada, o número de átomos de hidrogênio no composto deve ser especificado. Assim, o HdoisÉ chamado: seleneto de deramhidrogênio.
Seleneto ou hidreto?
Algumas fontes referem-se a ele como um hidreto. Se realmente fosse, o selênio teria uma carga positiva de +2 e o hidrogênio teria uma carga negativa de -1: SeHdois (Eu seidois+, H-) O selênio é um átomo mais eletronegativo do que o hidrogênio e, portanto, acaba "acumulando" a maior densidade de elétrons na molécula Hdoiseu sei.
No entanto, como tal, a existência de hidreto de selênio não pode ser teoricamente descartada. Na verdade, com a presença dos ânions H- Facilitaria as ligações Se-H-Se, responsáveis pelas estruturas sólidas formadas a enormes pressões de acordo com estudos computacionais..
Formulários
Metabólico
Embora pareça contraditório, apesar da grande toxicidade do HdoisÉ produzido no corpo na via metabólica do selênio. Porém, assim que é produzido, as células o utilizam como intermediário na síntese de selenoproteínas, ou acaba sendo metilado e excretado; um dos sintomas disso é o gosto de alho na boca.
Industrial
O HdoisÉ usado principalmente para adicionar átomos de selênio a estruturas sólidas, como materiais semicondutores; a moléculas orgânicas, como alcenos e nitrilos, para a síntese de selenetos orgânicos; ou a uma solução para precipitar selenetos metálicos.
Referências
- Wikipedia. (2018). Seleneto de hidrogênio. Recuperado de: en.wikipedia.org
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Atomistry. (2012). Seleneto de hidrogênio, HdoisEu sei. Recuperado de: selenium.atomistry.com
- Tang Y. & col. (2017). Seleneto de hidrogênio (HdoisSe) Gás dopante para implantação de selênio. 21ª Conferência Internacional sobre Tecnologia de Implantação de Íons (IIT). Tainan, Taiwan.
- Formulação química. (2018). Seleneto de hidrogênio. Recuperado de: formulacionquimica.com
- PubChem. (2019). Seleneto de hidrogênio. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Zhang, S. et al. (2015). Diagrama de fase e supercondutividade de alta temperatura de hidretos de selênio comprimido. Sci. Rep. 5, 15433; doi: 10.1038 / srep15433.
- Acids.Info. (2019). Ácido selenídrico: propriedades e aplicações deste hidrácido. Recuperado de: acidos.info/selenhidrico



Ainda sem comentários