
Estrutura, propriedades, usos, importância do sulfeto de hidrogênio (H2S)

O sulfato de hidrogênio ou o sulfeto de hidrogênio é um gás formado pela união de um átomo de enxofre (S) e dois átomos de hidrogênio (H). Sua fórmula química é HdoisS. Também conhecido como gás sulfeto de hidrogênio. É um gás incolor cujo odor é evidente em ovos podres.
Está presente em vulcões e fontes termais sulfurosas, no gás natural e no petróleo bruto. Também é formado durante a decomposição anaeróbica (sem oxigênio) da matéria orgânica vegetal e animal. Ocorre naturalmente no corpo dos mamíferos, por meio da ação de certas enzimas sobre a cisteína, um aminoácido não essencial.
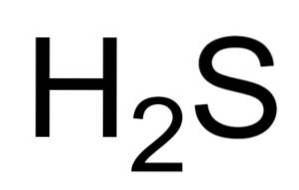
Soluções aquosas de HdoisS são corrosivos para metais como o aço. O HdoisS é um composto redutor que, ao reagir com SOdois , oxida em enxofre elementar, reduzindo a SOdois também enxofre.
Apesar de ser um composto altamente tóxico e fatal para humanos e animais, sua importância em uma série de processos importantes no organismo vem sendo estudada há alguns anos..
Regula uma série de mecanismos relacionados à geração de novos vasos sanguíneos e ao funcionamento do coração.
Protege os neurônios e acredita-se que atue contra doenças como Parkinson e Alzheimer.
Devido à sua capacidade redutora química, pode combater as espécies oxidativas, atuando assim contra o envelhecimento celular. Por esses motivos, está sendo estudada a possibilidade de produção de medicamentos que, quando administrados a pacientes, possam ser liberados lentamente no organismo..
Isso serviria para tratar patologias como isquemia, diabetes e doenças neurodegenerativas. No entanto, seu mecanismo de ação e sua segurança ainda não foram exaustivamente investigados..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades físicas
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Solubilidade
- 4 propriedades químicas
- 4.1 Em solução aquosa
- 4.2 Reação com oxigênio
- 4.3 Reação com metais
- 4.4 Reação com dióxido de enxofre
- 4.5 Decomposição com temperatura
- 5 Localização na natureza
- 6 Síntese no organismo mamífero
- 7 Obtido em laboratório ou industrialmente
- 8 Uso industrial de H2S para produzir enxofre
- 9 Utilidade ou importância do H2S endógeno no corpo
- 9.1 Sistema cardiovascular
- 9.2 Sistema gastrointestinal
- 9.3 Sistema nervoso central
- 9.4 Órgão de visão
- 9.5 Contra o envelhecimento
- 9.6 Potencial de cura de H2S fornecido exogenamente
- 10 riscos
- 11 referências
Estrutura
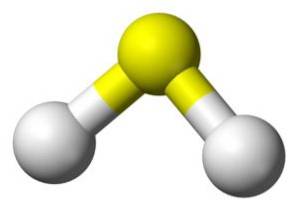
A molécula HdoisS é análogo ao da água, ou seja, eles são semelhantes em forma, uma vez que os hidrogênios estão localizados em um ângulo com o enxofre.
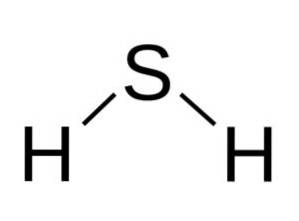
Enxofre em HdoisS tem a seguinte configuração eletrônica:
1sdois, 2sdois 2 P6, 3sdois 3p6,
Bem, ele pega emprestado um elétron de cada hidrogênio para completar sua camada de valência..
Nomenclatura
- Sulfato de hidrogênio
- Sulfato de hidrogênio
- Hidreto de enxofre.
Propriedades físicas
Estado físico
Gás incolor com um odor muito desagradável.
Peso molecular
34,08 g / mol.
Ponto de fusão
-85,60 ºC.
Ponto de ebulição
-60,75 ºC.
Densidade
1.1906 g / L.
Solubilidade
Moderadamente solúvel em água: 2,77 volumes em 1 de água a 20ºC. Pode ser desalojado da solução aquosa completamente fervendo.
Propriedades quimicas
Em solução aquosa
Quando o sulfeto de hidrogênio está em solução aquosa, é chamado de sulfeto de hidrogênio. É um ácido fraco. Possui dois prótons ionizáveis:
HdoisS + HdoisO ⇔ H3OU+ + HS-, Ka1 = 8,9 x 10-8
HS- + HdoisO ⇔ H3OU+ + Sdois-, Ka2 ∼ 10-14
O primeiro próton ioniza ligeiramente, como pode ser deduzido de sua primeira constante de ionização. O segundo próton ioniza muito pouco, mas as soluções de HdoisS contém um pouco do ânion sulfureto Sdois-.
Se a solução de HdoisS é exposto ao ar, Odois oxida em ânion sulfeto e precipita o enxofre:
2 Sdois- + 4 h+ + OUdois → 2 HdoisO + 2 S0↓ (1)
Na presença de cloro Cldois, bromo bromodois e iodo Idois o haleto de hidrogênio e o enxofre correspondentes são formados:
HdoisS + Brdois → 2 HBr + S0↓ (2)
Soluções aquosas de HdoisS são corrosivos, produzem fissuração por estresse de sulfeto em aços de alta dureza. Produtos de corrosão são sulfeto de ferro e hidrogênio.
Reação com oxigênio
O HdoisS reage com o oxigênio do ar e as seguintes reações podem ocorrer:
2 hdoisS + 3 Odois → 2 HdoisO + 2 SOdois (3)
2 hdoisS + Odois → 2 HdoisO + 2 S0↓ (4)
Reação com metais
Ele reage com vários metais que deslocam o hidrogênio e formam o sulfeto de metal:
HdoisS + Pb → PbS + Hdois↑ (5)
Reação com dióxido de enxofre
Em gases vulcânicos, HdoisS e SOdois, que reagem entre si e formam enxofre sólido:
HdoisS + SOdois → 2 HdoisO + 3 S0↓ (6)
Decomposição com temperatura
O sulfeto de hidrogênio não é muito estável, ele se decompõe facilmente quando aquecido:
HdoisS → Hdois↑ + S0↓ (7)
Localização na natureza
Este gás é encontrado naturalmente em fontes termais sulfurosas ou sulfurosas, em gases vulcânicos, em petróleo bruto e em gás natural..

Quando o óleo (ou gás) contém traços significativos de HdoisDiz-se que S é "azedo", em contraste com "doce", que é quando não o contém.
Pequenas quantidades de HdoisS em óleo ou gás são economicamente prejudiciais porque uma planta de depuração deve ser instalada para removê-los, tanto para evitar a corrosão quanto para tornar o gás residual seguro para uso doméstico como combustível.
É produzido sempre que a matéria orgânica contendo enxofre se decompõe em condições anaeróbias (ausência de ar), como resíduos humanos, animais e vegetais.

As bactérias presentes na boca e no trato gastrointestinal o produzem a partir de materiais degradáveis contidos em plantas ou proteínas animais..
Seu cheiro característico o torna perceptível em ovos podres.
O HdoisS também é produzido em certas atividades industriais, como refinarias de petróleo, fornos de coque, fábricas de papel, curtumes e no processamento de alimentos.
Síntese no organismo mamífero
O HdoisO S endógeno pode ser produzido em tecidos de mamíferos, incluindo humanos, por duas vias, uma enzimática e outra não enzimática.
A via não enzimática consiste na redução do enxofre elementar S0 para HdoisS por oxidação de glicose:
2 C6H12OU6 (glicose) + 6 S0 (enxofre) + 3 HdoisO → 3 C3H6OU3 + 6 hdoisS + 3 COdois (8)
A via enzimática consiste na produção de HdoisS de L-cisteína, que é um aminoácido sintetizado pelo corpo. O processo é garantido por várias enzimas, como a cistationina-β-sintase e a cistationina-γ-liase, entre outras..

Obtenção em laboratório ou industrialmente
Gás hidrogênio (Hdois) e o elemento enxofre (S) não reagem às temperaturas ambientes normais, mas acima destas começam a se combinar, sendo 310 ºC a temperatura ótima.
No entanto, o processo é muito lento, então outros métodos são usados para obtê-lo, incluindo o seguinte.
Sulfetos metálicos (como sulfeto ferroso) são reagidos com ácidos (como clorídrico) em solução diluída.
FeS + 2 HCl → FeCldois + HdoisS ↑ (9)
Desta forma, o gás HdoisS que, dada a sua toxicidade, deve ser coletado com segurança.
Uso industrial de HdoisS para produzir enxofre
Armazenamento e transporte em grandes quantidades de HdoisA separação de S do gás natural por lavagem de amina é difícil, então o processo de Claus é usado para convertê-lo em enxofre.

Duas reações ocorrem neste processo. No primeiro HdoisS reage com oxigênio para dar SOdois, como mencionado acima (ver reação 3).
A segunda é uma reação catalisada por óxido de ferro onde SOdois é reduzido e o HdoisS oxida e ambos produzem enxofre S (ver reação 6).
Dessa forma, obtém-se enxofre que pode ser facilmente armazenado e transportado, bem como destinado a usos múltiplos..
Utilidade ou importância de HdoisS endógeno no corpo
O HdoisS endógeno é aquele que ocorre naturalmente no corpo como parte do metabolismo normal em humanos, mamíferos e outros seres vivos.
Apesar de sua reputação de longa data como um gás tóxico e venenoso associado à decomposição de matéria orgânica, vários estudos recentes dos anos 2000 até o presente determinaram que HdoisS endógeno é um importante regulador de certos mecanismos e processos no ser vivo.
O HdoisS tem alta lipofilicidade ou afinidade com as gorduras, por isso atravessa as membranas celulares facilmente, penetrando em todos os tipos de células.
Sistema cardiovascular
Em mamíferos, o sulfeto de hidrogênio promove ou regula uma série de sinais que regulam o metabolismo, a função cardíaca e a sobrevivência celular..
Tem um efeito poderoso no coração, nos vasos sanguíneos e nos elementos circulantes do sangue. Modula o metabolismo celular e a função mitocondrial.
Defende os rins dos danos causados pela isquemia.
Sistema gastrointestinal
Desempenha importante papel como fator protetor contra danos à mucosa gástrica. Estima-se que pode ser um importante mediador da motilidade gastrointestinal.
Provavelmente está envolvido no controle da secreção de insulina.
Sistema nervoso central
Também atua em funções importantes do sistema nervoso central e protege os neurônios do estresse oxidativo.
Estima-se que possa proteger contra doenças neurodegenerativas como Parkinson, Alzheimer e doença de Hungtinton.
Órgão de visão
Protege as células fotorreceptoras da retina da degeneração induzida pela luz.
Contra o envelhecimento
O HdoisPor ser uma espécie redutora, pode ser consumido por diversos agentes oxidantes que circulam no corpo. Combate espécies oxidantes, como espécies reativas de oxigênio e espécies reativas de nitrogênio no corpo.
Limita as reações dos radicais livres por meio da ativação de enzimas antioxidantes que protegem contra os efeitos do envelhecimento.
Potencial de cura de HdoisS fornecido exogenamente
A biodisponibilidade de HdoisO S endógeno depende de certas enzimas envolvidas na biossíntese de cisteína em mamíferos.
Alguns estudos sugerem que a terapia medicamentosa do doador HdoisS pode ser benéfico para certas patologias.
Por exemplo, poderia ser útil em pacientes diabéticos, pois foi observado que os vasos sanguíneos de animais diabéticos melhoram com drogas que fornecem HdoisS exógeno.
O HdoisS fornecido exogenamente aumenta a angiogênese ou a formação de vasos sanguíneos, então pode ser usado para o tratamento de doenças isquêmicas crônicas.
Estão sendo inventadas drogas que podem liberar HdoisS lentamente para poder atuar de forma benéfica em várias doenças. No entanto, a eficácia, segurança e mecanismos de sua ação ainda não foram investigados..
Riscos
O HdoisS é um veneno fatal se inalado puro ou mesmo diluído 1 parte de gás em 200 partes de ar. Os pássaros são muito sensíveis a HdoisS e morrer mesmo na diluição de 1 em 1500 partes de ar.

O HdoisS é um potente inibidor de certas enzimas e processos de fosforilação oxidativa, levando à asfixia celular. A maioria das pessoas sente o cheiro em concentrações superiores a 5 ppb (partes por bilhão). Concentrações de 20-50 ppm (partes por milhão) são irritantes para os olhos e o trato respiratório.
Uma inalação de 100-250 ppm por alguns minutos pode causar incoordenação, distúrbios de memória e distúrbios motores. Quando a concentração está em torno de 150-200 ppm, ocorre fadiga olfatória ou anosmia, o que significa que depois o cheiro característico de H não pode ser detectado.doisS. Se uma concentração de 500 ppm for inalada por 30 minutos, pode ocorrer edema pulmonar e pneumonia..
Concentrações de mais de 600 ppm podem ser fatais nos primeiros 30 minutos, pois o sistema respiratório está paralisado. E 800 ppm é a concentração imediatamente letal para os humanos..
Portanto, deve-se evitar que haja vazamentos de HdoisS em laboratórios, instalações ou em qualquer lugar ou situação.
É importante notar que muitas mortes ocorrem porque as pessoas entram em espaços confinados para resgatar colegas de trabalho ou familiares que desmaiaram devido ao envenenamento por H.doisSim, passando por eles também.
É um gás inflamável.
Referências
- Panthi, S. et al. (2016). Importância fisiológica do sulfeto de hidrogênio: Neuroprotetor e neuromodulador potente emergente. Medicina Oxidativa e Longevidade Celular. Volume 2016. Artigo ID 9049782. Recuperado de hindawi.com.
- Shefa, U. et al. (2018). Funções antioxidantes e de sinalização celular do sulfeto de hidrogênio no sistema nervoso central. Medicina Oxidativa e Longevidade Celular. Volume 2018. Artigo ID 1873962. Recuperado de hindawi.com.
- Tabassum, R. et al. (2020). Importância terapêutica do sulfeto de hidrogênio em doenças neurodegenerativas associadas à idade. Neural Regen Res 2020; 15: 653-662. Recuperado de nrronline.org.
- Martelli, A. et al. (2010). Sulfeto de hidrogênio: nova oportunidade para descoberta de drogas. Revisões de pesquisas medicinais. Volume 32, edição 6. Recuperado de onlinelibrary.wiley.com.
- Wang, M.-J. et al. (2010). Mecanismos de angiogênese: Papel do sulfeto de hidrogênio. Clinical and Experimental Pharmacology and Physiology (2010) 37, 764-771. Recuperado de onlinelibrary.wiley.com.
- Dalefield, R. (2017). Fumaça e outros tóxicos inalados. Sulfato de hidrogênio. Em Toxicologia Veterinária para Austrália e Nova Zelândia. Recuperado de sciencedirect.com.
- Selley, R.C. e Sonnenberg, S.A. (2015). As propriedades físicas e químicas do petróleo. Sulfato de hidrogênio. Em Elementos de Geologia de Petróleo (Terceira Edição). Recuperado de sciencedirect.com.
- Hocking, M.B. (2005). Enxofre e ácido sulfúrico. Processo de Claus Conversão de Sulfeto de Hidrogênio em Enxofre. No Manual de Tecnologia Química e Controle de Poluição (Terceira Edição). Recuperado de sciencedirect.com.
- Lefer, D.J. (2008). Importância potencial das alterações no sulfeto de hidrogênio (HdoisS) biodisponibilidade em diabetes. British Journal of Pharmacology (2008) 155, 617-619. Recuperado de bpspubs.onlinelibrary.wiley.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Sulfato de hidrogênio. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Babor, J.A. e Ibarz, J. (1965). Química Geral Moderna. 7ª Edição. Editorial Marín, S.A.



Ainda sem comentários