
Estrutura, propriedades, riscos e usos do ácido iódico (HIO3)

O ácido iódico é um composto inorgânico de fórmula HIO3. É um ácido oxácido de iodo, que possui um estado de oxidação de +5 nesta molécula. Este composto é um ácido muito forte e é freqüentemente usado para padronizar soluções de bases fortes e fracas para prepará-las para titulações..
É formado pela oxidação do iodo diatômico com ácido nítrico, cloro, peróxido de hidrogênio ou ácido clorídrico, conforme mostrado na seguinte reação: Idois + 6hdoisO + 5Cldois ⇌ 2HIO3 + 10HCl.
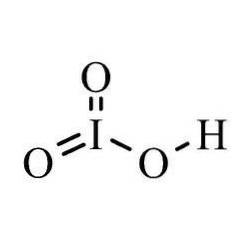
Em cada reação, o iodo diatômico perde elétrons e forma um complexo com hidrogênio e oxigênio. Devido às suas propriedades iônicas e solúveis, o ácido iônico também é um ácido muito forte..
Índice do artigo
- 1 Propriedades físicas e químicas do ácido iódico
- 2 Reatividade e perigos
- 3 usos e benefícios para a saúde
- 4 referências
Propriedades físicas e químicas do ácido iódico
O ácido iódico é um sólido branco à temperatura ambiente (Royal Society of Chemistry, 2015).

O ácido iódico tem um peso molecular de 175,91 g / mol e uma densidade de 4,62 g / ml. É muito solúvel em água, podendo dissolver 269 gramas de ácido por 100 ml. Seu ponto de fusão é 110 graus Celsius, onde começa a se decompor desidratando em pentóxido de iodo.
Com o aquecimento subsequente do composto a uma temperatura mais alta, ele se decompõe para dar uma mistura de iodo, oxigênio e óxidos de iodo mais baixos (National Center for Biotechnology Information, S.F.).
É um ácido relativamente forte com uma acidez de 0,75. O iodo ou íon iodeto é o produto desse composto quando é oxidado. Em pH muito baixo e alta concentração de íon cloreto, é reduzido a tricloreto de iodo, que é um composto amarelo em solução.
Reatividade e perigos
O ácido iódico é um composto estável em condições normais. Por ser um ácido forte, é extremamente perigoso em caso de contato com a pele (corrosivo e irritante), contato com os olhos (irritante) e em caso de ingestão. Além disso, é muito perigoso também em caso de inalação (IODIC ACID, S.F.).
A quantidade de dano ao tecido depende da duração do contato. O contato com os olhos pode resultar em danos à córnea ou cegueira. O contato com a pele pode causar inflamação e bolhas. A inalação de poeira causa irritação do trato gastrointestinal ou respiratório, caracterizada por queimação, espirros e tosse..
A superexposição severa pode causar danos aos pulmões, sufocação, perda de consciência ou morte. A exposição prolongada pode causar queimaduras e ulcerações na pele. A superexposição por inalação pode causar irritação respiratória..
A inflamação do olho é caracterizada por vermelhidão, lacrimejamento e coceira. A inflamação da pele é caracterizada por coceira, descamação, vermelhidão ou, ocasionalmente, bolhas.
A substância é tóxica para os rins, pulmões e membranas mucosas.
A exposição repetida ou prolongada à substância pode causar danos a esses órgãos e irritação aos olhos. A exposição periódica da pele pode causar destruição local da pele ou dermatite..
A inalação repetida de poeira pode produzir vários graus de irritação respiratória ou danos aos pulmões. A inalação prolongada de poeira pode causar irritação respiratória crônica..
Em caso de contato com os olhos, verifique se está usando lentes de contato e remova-as imediatamente. Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas, podendo-se usar água fria. Pomada para os olhos não deve ser usada.
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas mãos e corpo. Coloque a vítima sob um chuveiro de emergência.
Se o produto químico se acumular na pele exposta da vítima, como nas mãos, a pele contaminada é lavada com cuidado e cuidado com água corrente e sabão não abrasivo. Se a irritação persistir, procure atendimento médico e lave as roupas contaminadas antes de reutilizá-las..
Se o contato com a pele for grave, deve-se lavar com sabonete desinfetante e cobrir a pele contaminada com creme antibacteriano..
Em caso de inalação, a vítima deve ser deixada repousar em área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível e as roupas justas (gola da camisa, cintos ou gravata) devem ser afrouxadas..
Se a vítima tiver dificuldade para respirar, deve-se administrar oxigênio. No caso extremo de não respirar, é realizada a ressuscitação boca a boca. Claro, deve-se levar em conta que pode ser perigoso para a pessoa que presta ajuda quando o material inalado é tóxico, infeccioso ou corrosivo.
Em caso de ingestão, não induza o vômito, afrouxe as roupas e, se a vítima não estiver respirando, faça a ressuscitação boca-a-boca.
Em todos os casos, deve-se procurar atendimento médico imediato (Folha de Dados de Segurança do Material, ácido iódico, 2013).
Usos e benefícios para a saúde
O ácido iódico é comumente usado como agente padronizador para soluções de bases fortes e fracas. É um ácido forte usado em química analítica para realizar titulações.
Usado com indicadores de vermelho de metila ou laranja de metila para realizar leituras de ponto de equivalência em titulações.
É usado na indústria do sal para sintetizar o sal iodato de sódio ou potássio. Ao usar este composto de ácido iódico na preparação do sal, o teor de iodo do sal é aumentado (Omkar Chemicals, 2016).
Este composto é utilizado há muito tempo para síntese orgânica, uma vez que tem a capacidade de oxidar seletivamente compostos orgânicos, dada sua ação de realizar análises de oxidação parcial equivalente, uma técnica útil para determinar estruturas (Roger J. Williams, 1937).
Iodo e ácido iódico são usados como uma combinação eficiente de reagentes para a iodação de aril hidroxicetonas. No trabalho de (Bhagwan R. Patila, 2005), uma variedade de compostos de carbonila aromáticos substituídos em orto-hidroxi foram iodados regiosseletivamente com iodo e ácido iódico com excelentes rendimentos..
Referências
- Bhagwan R. Patila, S. R. (2005). Iodo e ácido iódico: uma combinação de reagentes eficiente para iodação de aril hidroxicetonas. Tetrahedron Letters Volume 46, Issue 42, 7179-7181. arkat-usa.org.
- ÁCIDO IÓDICO. (S.F.). Obtido em chemicalland21: chemicalland21.com.
- Folha de dados de segurança do material Ácido iódico. (2013, 21 de maio). Obtido em sciencelab: sciencelab.com.
- Centro Nacional de Informações sobre Biotecnologia. (S.F.). PubChem Compound Database; CID = 24345. Obtido em PubChem.
- Omkar Chemicals. (2016, 11 de junho). NATUREZA DO ÁCIDO IÓDICO E SEUS USOS EM VÁRIOS FINS. Obtido do blog oficial da Omkar Chemicals: omkarchemicals.com.
- Roger J. Williams, M. A. (1937). A SELETIVIDADE DO ÁCIDO IÓDICO NA OXIDAÇÃO DE COMPOSTOS ORGÂNICOS. jornal da sociedade química americana 59 (7), 1408-1409.
- Royal Society of Chemistry. (2015). Ácido iódico. Obtido em chemspider: chemspider.com.



Ainda sem comentários