
Estrutura, funções, inibidores da citocromo c oxidase
O citocromo c oxidase É um complexo de proteínas enzimáticas que podem atravessar a bicamada lipídica da membrana celular. É hemossolúvel e está principalmente associado à membrana interna da mitocôndria, sendo encontrado tanto em organismos procarióticos (bactérias) quanto em eucariotos (unicelulares e multicelulares)..
Também chamada de complexo IV, essa enzima é vital nas funções metabólicas aeróbicas dos organismos, pois é essencial na cadeia de transporte de elétrons na qual a célula queima açúcares e captura parte da energia liberada para armazenar trifosfato de adenosina ou ATP..
O nome citocromo significa "pigmentos celulares". Estas são proteínas do sangue que carregam elétrons. Os citocromos foram descobertos pelo médico irlandês Charles Alexander MacMunn em 1884. MacMunn foi o pioneiro na descoberta do pigmento respiratório no sangue, hoje chamado de citocromo 1..
Na década de 1920, o entomologista e parasitologista russo David Keilin redescobriu e caracterizou os pigmentos respiratórios e foi quem os chamou de citocromos. Embora MacMunn os tenha descoberto em 1884, a comunidade científica o esqueceu e alguns até interpretaram mal seu trabalho..
Índice do artigo
- 1 características gerais
- 1.1 -Citocromo c
- 2 Citocromo c oxidase ou Complexo IV
- 3 Estrutura
- 4 funções
- 4.1 Apoptose ou morte celular programada
- 4.2 Regeneração de células ou tecidos
- 4.3 Metabolismo de energia
- 5 inibidores
- 6 Deficiência
- 7 usos na filogenia
- 8 referências
Características gerais
Em geral, os pigmentos respiratórios têm espectros de luz visível característicos. Sabe-se que existem pelo menos quatro complexos de proteínas de membrana integral onde existem 5 tipos diferentes de citocromos: a, a3, b, c1 e c, classificados de acordo com os comprimentos de onda dos máximos de absorção espectral.
Eles geralmente são encontrados na membrana interna da mitocôndria. No entanto, eles também foram observados no retículo endoplasmático e cloroplastos, em organismos eucarióticos e procarióticos..
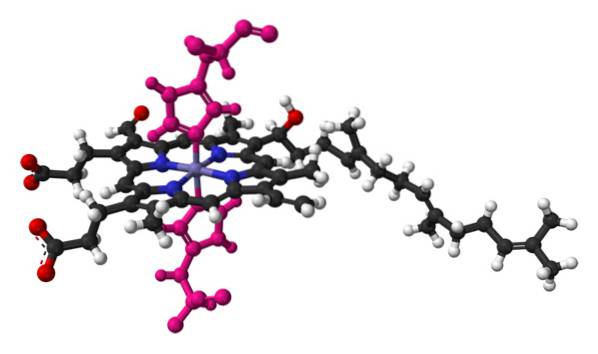
Apresentam o grupo protético heme contendo ferro (Fe). Cada um dos citocromos conhecidos atua em complexos multienzimáticos no transporte de elétrons no processo ou cadeia respiratória..
Os citocromos têm a função de participar das reações de oxidação-redução. As reações de redução, onde aceitam elétrons, ocorrem de forma diferente para cada tipo de citocromo, e seu valor é determinado pelo fluxo de elétrons da cadeia respiratória..
-Citocromo c
Quatro classes de citocromo c são conhecidas, que são as seguintes.
Classe I
Dentro desta classe estão os citocromos solúveis de baixo spin c (lowspin), presentes em bactérias e mitocôndrias. Eles são octaédricos. O local de ligação do heme está no terminal N da histidina e o sexto ligante é fornecido por um resíduo de metionina no terminal C..
Desta classe, várias subclasses podem até ser reconhecidas, cuja estrutura tridimensional foi determinada..
Classe II
O citocromo c de spin alto e algum citocromo c de baixo spin são encontrados nesta classe. Os de alta rotação têm o local de ligação próximo ao terminal C e, nos de baixa rotação, o sexto ligante parece ser um resíduo de metionina próximo ao N-terminal. Eles são pentacoordinados com histidina do quinto ligante.
Classe III
Esta classe é caracterizada por apresentar citocromos c com múltiplos heme (c3 e c7) e baixo potencial redutor de óxido, com apenas 30 resíduos de aminoácidos por grupo heme. Em representantes dessa classe, os grupos heme c têm estrutura e funções não equivalentes, além de apresentarem potenciais redox diferentes. São octaédricos.
Classe IV
Segundo alguns autores, essa classe foi criada apenas para incluir proteínas complexas que outros grupos protéticos apresentam, além do heme c, ou flavocitocromo c, entre outros..
Citocromo c oxidase ou complexo IV
A citocromo c oxidase é uma enzima mitocondrial que realiza a fase final do transporte de elétrons na respiração celular. Esta enzima catalisa o transporte de elétrons do citocromo c reduzido para o oxigênio..
Alguns compostos químicos, como cianeto, dióxido de carbono e azida, podem inibir o funcionamento dessa enzima, causando a chamada asfixia química celular. Outras formas de inibição do complexo IV são mutações genéticas.
Do ponto de vista evolutivo, a citocromo c oxidase só é encontrada em organismos aeróbios, e vários grupos de cientistas sugerem que a presença dessa proteína indica relações evolutivas onde plantas, fungos e também animais compartilharam um ancestral comum..
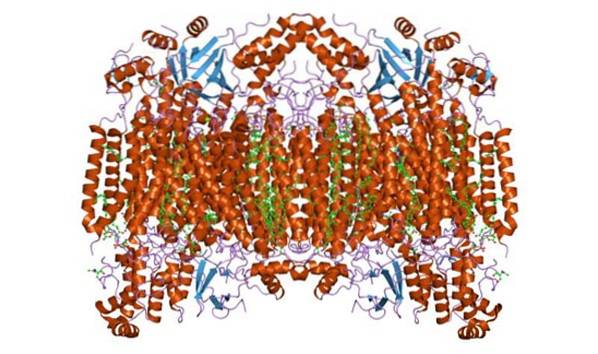
Estrutura
A citocromo c oxidase forma um complexo homodimérico, ou seja, composto por dois monômeros semelhantes na membrana interna da mitocôndria. O complexo enzimático consiste em 3 a 4 subunidades em organismos procarióticos e até um máximo de 13 (alguns sugerem 14) polipeptídeos em organismos como mamíferos..
Nestes organismos, 3 polipeptídeos são de origem mitocondrial e o restante se origina no núcleo. Cada monômero tem 28 hélices transmembrana que separam os domínios hidrofílicos contra a matriz da membrana e o espaço intermembranar..
Possui uma única unidade catalítica, presente em todas as enzimas que catalisam reações de oxidação / redução, utilizando oxigênio molecular (oxidases, principalmente heme-cobre). O complexo contém citocromos a e a3 ligados pela subunidade I e dois centros de cobre.
Possui um ou mais grupos heme C ligados à estrutura da proteína circundante por uma ou mais (geralmente duas) ligações tioéter. Outros autores sugerem que existe um único grupo heme C covalentemente ligado à proteína entre o anel de porfirina e dois resíduos de cisteína..
O único grupo heme c mencionado acima é rodeado por resíduos hidrofóbicos e é hexacoordinado, com histidina na posição 18 da cadeia polipeptídica e metionina na posição 80..
Características
As citocromo c oxidases são protagonistas em três mecanismos fisiológicos principais, que veremos a seguir.
Apoptose ou morte celular programada
A apoptose é a destruição ou morte celular programada, causada pelo próprio organismo e que tem por objetivo controlar o crescimento, o desenvolvimento, a eliminação de tecidos danificados e a regulação do sistema imunológico. Nesse processo fisiológico, a citocromo c oxidase participa como um intermediário.
Essa proteína, liberada pela mitocôndria, leva a uma interação com o retículo endoplasmático, que causa a secreção ou liberação de cálcio. O aumento progressivo do cálcio desencadeia uma liberação maciça de citocromo c oxidase, até que os níveis citotóxicos de cálcio sejam atingidos..
Os níveis de cálcio citotóxico e a liberação de citocromos c causam a ativação em cascata de várias enzimas caspases, que são responsáveis pela destruição das células..
Regeneração de células ou tecidos
Vários estudos indicam que quando a citocromo c oxidase é exposta a comprimentos de onda de 670 nanômetros, ela participa de um complexo funcional que penetra no tecido danificado ou lesado e aumenta a taxa de regeneração celular..
Metabolismo de energia
Esta é talvez a função mais conhecida e relevante da citocromo c oxidase. É justamente o complexo oxidase (da cadeia respiratória) o responsável por coletar os elétrons do citocromo ce transferi-los para a molécula de oxigênio, reduzindo-a a duas moléculas de água..
Conectado a esse processo, ocorre uma translocação de prótons através da membrana, resultando na geração de um gradiente eletroquímico que o complexo ATP sintetase usa para produzir ou sintetizar ATP (adenosina trifosfato)..
Inibidores
A citocromo c oxidase é inibida por vários compostos e processos químicos. A forma como isso ocorre pode surgir como uma forma natural de regular a produção ou ação da enzima ou pode ocorrer acidentalmente devido a envenenamento.
Na presença de azida, cianeto ou monóxido de carbono, a citocromo c oxidase liga-se a estes e o funcionamento do complexo proteico é inibido. Isso causa uma interrupção no processo respiratório celular e, portanto, causa a asfixia química das células..
Outros compostos, como óxido nítrico, sulfeto de hidrogênio, metanol e alguns álcoois metilados, também causam a inibição da citocromo c oxidase..
Deficiência
A citocromo c oxidase é uma enzima controlada por genes no núcleo e na mitocôndria. Existem alterações genéticas ou mutações que podem levar a uma deficiência da citocromo c oxidase.
Essas mutações perturbam a funcionalidade da enzima, pois alteram sua estrutura enzimática, trazendo consigo distúrbios metabólicos durante o desenvolvimento embrionário (segundo estudos em humanos), que afetarão posteriormente o organismo nos primeiros anos de vida..
A deficiência de citocromo c oxidase afeta tecidos com alta demanda de energia, como coração, fígado, cérebro e músculos. Os sintomas dessas mutações são refletidos antes dos dois anos de vida e podem se manifestar como condições fortes ou leves.
Os sintomas leves podem ser vistos logo após o primeiro ano de idade, e os indivíduos com eles geralmente apresentam apenas diminuição da tensão muscular (hipotonia) e atrofia muscular (miopatia)..
Por outro lado, indivíduos com sintomas mais fortes podem apresentar atrofia muscular e encefalomiopatia. Outras condições causadas pela ausência de citocromo c oxidase são cardiomiopatia hipertrófica, aumento patológico do fígado, síndrome de Leigh e acidose láctica..
Usos na filogenia
A filogenia é a ciência responsável pelos estudos da origem, formação e desenvolvimento evolutivo, do ponto de vista ancestral-descendente, dos organismos. Nas últimas décadas, estudos de filogenia com análise molecular têm sido cada vez mais frequentes, gerando muitas informações e resolvendo problemas taxonômicos..
Nesse sentido, alguns estudos filogenéticos indicam que o uso de citocromo c oxidases pode ajudar a estabelecer relações evolutivas. Isso ocorre porque esse complexo de proteínas é altamente conservado e está presente em uma ampla variedade de organismos, desde protistas unicelulares a grandes vertebrados..
Um exemplo disso são os testes feitos com humanos, chimpanzés (Pão paniscus) e macacos Rhesus (Macaca mulata) Esses testes revelaram que as moléculas de citocromo c oxidase humana e de chimpanzé eram idênticas..
Também mostrou que as moléculas de citocromo c oxidase do macaco Rhesus diferiam em um aminoácido das dos dois primeiros, reafirmando, conseqüentemente, as relações ancestrais-descendentes entre chimpanzés e humanos..
Referências
- R.P. Ambler (1991). Variabilidade da sequência em citocromos bacterianos c. Biochimica et Biophysica Acta (BBA) - Bioenergética.
- Citocromo c. Recuperado de newworldencyclopedia.org.
- V. Colman, E. Costa, R. Chaves, V. Tórtora (2015). Papéis biológicos do citocromo c: transporte mitocondrial de elétrons, morte celular programada e ganho na atividade do peróxido. Anais da Faculdade de Medicina.
- Subunidade I da citocromo c oxidase. Recuperada de ebi.ac.uk.
- L. Youfen, P. Jeong-Soon, D. Jian-Hong e B. Yidong (2007). A subunidade IV da citocromo c oxidase é essencial para a montagem e a função respiratória do complexo enzimático. Journal of Bioenergetics and Biomembranes.
- Grupo gênico: Complexo mitocondrial IV: subunidades da citocromo c oxidase (COX, MT-CO). Recuperado de genenames.org.
- E.F. Hartree (1973). A descoberta do citocromo. Educação Bioquímica.
- Citocromo c oxidase, deficiência de…. Recuperado de ivami.com.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Bioquímica. 3ª edição. Benjamin / Cummings Publishing Company, Inc.

Ainda sem comentários