
Propriedades, estrutura, usos, riscos do cloreto de manganês

O cloreto de manganês é um sal inorgânico cuja fórmula química é MnCldois. É composto de íons Mndois+ e Cl- em uma proporção de 1: 2; para cada cátion Mndois+ há o dobro de ânions Cl-.
Este sal pode formar vários hidratos: MnCldois2hdoisO, (dihidrato), MnCldois4hdoisO (tetra-hidrato) e MnCldois6hdoisO (hexahidrato) A forma mais comum de sal é o tetrahidrato.

As propriedades físicas do cloreto de manganês, como densidade, ponto de fusão e solubilidade em água, são influenciadas pelo seu grau de hidratação. Por exemplo, o ponto de fusão da forma anidra é muito maior do que o da forma tetra-hidratada..
A cor do cloreto de manganês é rosa claro (imagem de cima). Palidez é característica dos sais de metais de transição. O cloreto de manganês é um ácido de Lewis fraco.
O mineral conhecido como escacquita é a forma naturalmente anidra do cloreto de manganês (II); como o kempita.
O cloreto de manganês (II) é usado como um agente de liga; catalisador em reações de cloração, etc..
Índice do artigo
- 1 propriedades físicas
- 1.1 Aparência física
- 1,2 massas molares
- 1.3 Pontos de fusão
- 1.4 Ponto de ebulição
- 1.5 Densidades
- 1.6 Solubilidade em água
- 1.7 Solubilidade em solventes orgânicos
- 1.8 Decomposição
- 1,9 pH
- 1,10 Estabilidade
- 2 Estrutura do cloreto de manganês
- 2.1 Diidrato
- 2.2 Anidro
- 3 Nomenclatura
- 4 usos
- 4.1 Laboratório
- 4.2 Indústria
- 4.3 Fertilizante e ração animal
- 5 riscos
- 6 referências
Propriedades físicas
Aspecto físico
- Forma anidra: cristais cúbicos rosa.
- Forma tetrahidrato: cristais monoclínicos avermelhados ligeiramente deliquescentes.
Massas molares
- Anidro: 125,838 g / mol.
- Dihidrato: 161,874 g / mol.
- Tetrahidrato: 197,91 g / mol.
Pontos de fusão
- Anidro: 654 ºC.
- Diidrato: 135 ºC.
- Tetrahidrato: 58 ºC.
Ponto de ebulição
Forma anidra: 1.190 ºC.
Densidades
- Anidro: 2.977 g / cm3.
- Dihidrato: 2,27 g / cm3.
- Tetrahidrato: 2,01 g / cm3.
Solubilidade em água
Forma anidra: 63,4 g / 100 ml a 0 ° C; 73,9 g / 100 ml a 20 ° C; 88,5 g / 100 ml a 40 ° C; e 123,8 g / 100 ml a 100 ° C.
Solubilidade em solventes orgânicos
Solúvel em piridina e etanol, insolúvel em éter.
Decomposição
A menos que os devidos cuidados sejam tomados, a desidratação das formas hidratadas para a forma anidra pode levar à desidratação hidrolítica, com a produção de cloreto de hidrogênio e oxicloreto de manganês..
pH
Uma solução 0,2 M de tetra-hidrato de cloreto de manganês em solução aquosa tem um pH de 5,5.
Estabilidade
É estável, mas sensível à umidade e incompatível com ácidos fortes, metais reativos e peróxido de hidrogênio.
Estrutura do cloreto de manganês

Começando pelo sal tetraidratado, com cristais rosa marcantes, ele deve ser composto de complexos de coordenação (imagem de cima). Neles, o centro metálico de Mndois+ é cercado por um octaedro definido por quatro moléculas de HdoisO e dois ânions Cl-.
Observe que os ligantes Cl- estão em posições cis; todos são equivalentes na base retangular do octaedro, e não importa se o Cl é "movido"- para qualquer uma das outras três posições. Outro isômero possível para esta molécula coordenada é em que ambos Cl- estão em posições trans; ou seja, em extremos diferentes (um acima e o outro abaixo).
As quatro moléculas de água com suas ligações de hidrogênio permitem que dois ou mais octaedros sejam unidos por forças dipolo-dipolo. Essas pontes são altamente direcionais e adicionando as interações eletrostáticas entre o Mndois+ e Cl-, estabelecer uma estrutura ordenada característica de um cristal.
A cor rosa do MnCldois4hdoisOu é devido às transições eletrônicas do Mndois+ e sua configuração d5. Da mesma forma, os distúrbios causados pela proximidade de moléculas de água e cloretos modificam a quantidade de energia necessária para ser absorvida por tais elétrons d5 viajar com níveis de energia mais elevados.
Diidrato
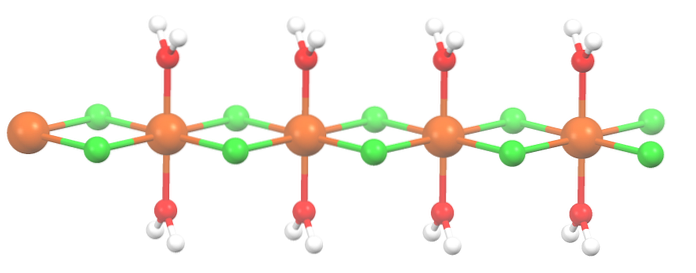
O sal foi desidratado e sua fórmula agora é MnCldois2hdoisO. E o octaedro acima? Nada, exceto que as duas moléculas de HdoisOu que caíram são substituídos por dois Cl-.
No início, você pode dar a impressão errada de que existem quatro Cl- para cada Mndois+; no entanto, a metade do octaedro (axialmente) é na verdade a unidade de repetição do cristal.
Assim, é verdade que existe um Mndois+ coordenado a dois Cl- e duas moléculas de água nas posições trans. Mas para essa unidade interagir com outra, ela precisa de duas pontes de Cl, que por sua vez permitem que o octaedro de coordenação para o manganês seja concluído..
Além das pontes de Cl, as moléculas de água também colaboram com suas ligações de hidrogênio para que esta cadeia de MnCldois2hdoisOu não desarme.
Anidro
Finalmente, o cloreto de magnésio acabou perdendo toda a água contida em seus cristais; agora temos o sal anidro, MnCldois. Sem as moléculas de água, os cristais perdem visivelmente a intensidade de sua coloração rosa. O octaedro, quanto aos hidratos, permanece inalterado pela própria natureza do manganês.
Sem moléculas de água, Mndois+ termina rodeado por um octaedro composto apenas de Cl-. Essa ligação de coordenação é de caráter covalente e iônico; por este motivo, geralmente se refere à estrutura de MnCldois como um cristal polimérico. Nele existem camadas alternadas de Mn e Cl.
Nomenclatura
O manganês tem muitos estados de oxidação possíveis. Por causa disso, a nomenclatura tradicional para MnCldois não está esclarecido.
Por outro lado, o cloreto de manganês corresponde ao seu nome mais conhecido, ao qual seria necessário adicionar o '(II)' para que ficasse de acordo com a nomenclatura de estoque: cloreto de manganês (II). E da mesma forma, existe a nomenclatura sistemática: dicloreto de manganês.
Formulários
Laboratório
O cloreto de manganês serve como um catalisador para a cloração de compostos orgânicos.
Indústria
O cloreto de manganês é utilizado como matéria-prima na fabricação de antidetonantes para a gasolina; material de soldagem para metais não ferrosos; intermediário na fabricação de pigmentos; e secador de óleo de linhaça.
É utilizado na indústria têxtil para estamparia e tinturaria; na produção de vários sais de manganês, incluindo metilciclopentadienilmanganês tricarbonil usado como um corante de tijolo; e na produção de células elétricas secas.
O cloreto de manganês é usado como um agente de liga e é adicionado ao magnésio fundido para produzir ligas de manganês-magnésio; como intermediário na preparação de agentes secantes para tintas e vernizes; e como um componente de desinfetantes.
Também é usado na purificação de magnésio.
Fertilizante e ração animal
O cloreto de manganês é utilizado como fonte de manganês, elemento que, embora não seja um elemento nutricional primário para plantas como nitrogênio, fósforo e potássio, é utilizado em inúmeras reações bioquímicas típicas desses seres vivos..
Da mesma forma, é adicionado à alimentação de animais reprodutores para fornecer manganês, um oligoelemento essencial para o crescimento dos animais..
O cloreto de manganês é um componente alimentar que fornece manganês, elemento que está envolvido em muitos processos necessários à vida, incluindo: síntese de ácidos graxos e hormônios sexuais; assimilação de vitamina E; produção de cartilagem; etc.
Riscos
Pode causar vermelhidão, irritação e dermatite em contato com a pele. O cloreto de manganês causa olhos vermelhos, feridos e lacrimejantes.
Quando inalado, o sal causa tosse, dor de garganta e falta de ar. Por outro lado, a ingestão pode causar vômitos, náuseas e diarréia..
A inalação excessiva crônica desse sal pode causar inflamação pulmonar e subsequente doença reativa das vias aéreas..
Sua ingestão excessiva pode causar transtornos mentais, desidratação, hipotensão, insuficiência hepática e renal, falência do sistema multiorgânico e morte..
A neurotoxicidade é a manifestação inicial da ação indesejável do manganês, podendo apresentar cefaleia, tontura, perda de memória, hiperreflexia e tremor leve..
A toxicidade grave é manifestada por sintomas e sinais semelhantes aos observados na doença de Parkinson.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Cloreto de manganês (II). Recuperado de: en.wikipedia.org
- Nanomateriais Sky Spring. (2016). Pó de cloreto de manganês. Recuperado de: ssnano.com
- Livro Químico. (2017). Cloreto de manganês. Recuperado de: chemicalbook.com
- Rede de dados toxicológicos. (s.f.). Cloreto de manganês. Toxnet. Recuperado de: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Cloreto de manganês (II). doi.org/10.1002/047084289X.rm020
- Centro Nacional de Informações sobre Biotecnologia. (2019). Dicloreto de manganês. Banco de dados PubChem. CID = 24480. Recuperado de: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Minerais: manganês. Recuperado de: webconsultas.com



Ainda sem comentários