
Construção de configuração de kernel eletrônico, exemplos
O configuração de elétron do kernel ou compacto é aquele cujas notações quânticas para o número de elétrons e seus subníveis de energia são abreviadas pelos símbolos de gás nobre entre colchetes. É muito útil na hora de escrever configurações eletrônicas para um determinado elemento, pois é simples e rápido.
A palavra 'kernel' geralmente se refere às camadas eletrônicas internas de um átomo; isto é, aqueles em que seus elétrons não são de valência e, portanto, não participam da ligação química, embora definam as propriedades do elemento. Metaforicamente falando, o kernel seria o interior da cebola, com suas camadas compostas por uma série de orbitais aumentando em energia.
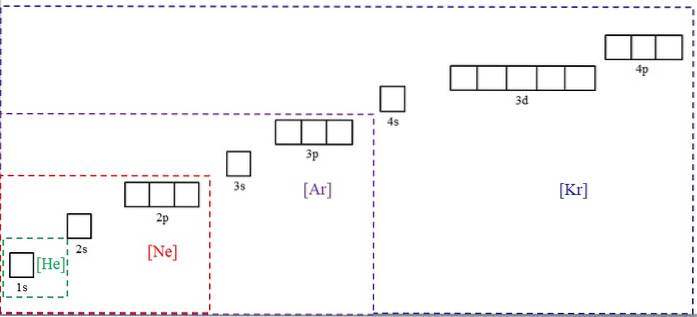
A imagem acima mostra os símbolos químicos para quatro dos gases nobres entre colchetes e com cores diferentes: [He] (verde), [Ne] (vermelho), [Ar] (roxo) e [Kr] (azul).
Cada um de seus quadros pontilhados contém caixas que representam os orbitais. Quanto maiores são, maior é o número de elétrons que contêm; o que, por sua vez, significa que as configurações eletrônicas de mais elementos podem ser simplificadas com esses símbolos. Isso economiza tempo e energia escrevendo todas as notações.
Índice do artigo
- 1 pedido de construção
- 2 Abreviatura de configuração eletrônica
- 3 exemplos
- 3.1 Geral
- 3.2 Oxigênio
- 3,3 potássio
- 3.4 índio
- 3,5 Tungstênio
- 4 referências
Ordem de construção
Antes de usar as configurações eletrônicas do kernel, é uma boa ideia revisar a ordem correta para construir ou escrever essas configurações. Isso é governado de acordo com a regra das diagonais ou diagrama de Moeller (chamado em algumas partes de método da chuva). Tendo este diagrama em mãos, as notações quânticas são as seguintes:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Essa sequência de notações quânticas parece extenuante; e seria ainda mais se tivesse que ser escrito toda vez que a configuração eletrônica de qualquer elemento encontrado no período 5 em diante fosse representada. Observe também que a corda está vazia de elétrons; não há números nos ângulos superiores direitos (1sdois2sdois2 P6…).
Deve ser lembrado que os orbitais s pode “abrigar” dois elétrons (nsdois) Orbitais p há três no total (veja as três caixas acima), para que possam acomodar seis elétrons (np6) E finalmente, os orbitais d são cinco, e o F sete, tendo um total de dez (nd10) e quatorze (nf14) elétrons, respectivamente.
Abreviatura para configuração eletrônica
Tendo dito o acima, prosseguimos para preencher a linha anterior de notações quânticas com elétrons:
1sdois 2sdois 2 P6 3sdois 3p6 4sdois 3d10 4p6 5sdois 4d10 5 p6 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6
Quantos elétrons existem ao todo? 118. E a qual elemento corresponde um número tão grande de elétrons em seu átomo? Para o gás nobre oganeson, Og.
Suponha que haja um elemento com um número quântico Z igual a 119. Então, sua configuração de elétron de valência seria 8s1; mas qual seria sua configuração eletrônica completa?
1sdois 2sdois 2 P6 3sdois 3p6 4sdois 3d10 4p6 5sdois 4d10 5 p6 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6 8s1
E qual seria a configuração do seu kernel eletrônico, o compacto? Está:
[Og] 8s1
Observe a simplificação ou abreviação óbvia. No símbolo [Og] todos os 118 elétrons escritos acima são contados, então este elemento incerto tem 119 elétrons, dos quais apenas um é de valência (estaria localizado abaixo do frâncio na tabela periódica).
Exemplos
em geral
Suponha agora que você deseja fazer a abreviatura progressivamente:
[He] 2sdois 2 P6 3sdois 3p6 4sdois 3d10 4p6 5sdois 4d10 5 p6 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6
Observe que 1sdois foi substituído por [He]. O próximo gás nobre é o neon, que possui 10 elétrons. Sabendo disso, a abreviatura continua:
[Ne] 3sdois 3p6 4sdois 3d10 4p6 5sdois 4d10 5 p6 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6
Em seguida, o argônio segue, com 18 elétrons:
[Ar] 4sdois 3d10 4p6 5sdois 4d10 5 p6 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6
Como o próximo gás nobre é o criptônio, a abreviação é avançada por outros 36 elétrons:
[Kr] 5sdois 4d10 5 p6 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6
O xenônio tem 54 elétrons e, portanto, movemos a abreviatura para o orbital 5p:
[Xe] 6sdois 4f14 5 d10 6p6 7sdois 5f14 6d10 7p6
Agora você deve ter notado que a configuração do elétron é sempre abreviada para orbital np; ou seja, os gases nobres têm esses orbitais preenchidos com elétrons. E finalmente vem o radônio, com 86 elétrons, então abreviamos para o orbital 6p:
[Rn] 7sdois 5f14 6d10 7p6
Oxigênio
O oxigênio tem oito elétrons, sendo sua configuração eletrônica completa:
1sdois2sdois2 P4
A única abreviatura que podemos usar é [He] para 1sdois. Assim, sua configuração de kernel eletrônico torna-se:
[He] 2sdois2 P4
Potássio
O potássio possui dezenove elétrons, sendo sua configuração eletrônica completa:
1sdois 2sdois 2 P6 3sdois 3p6 4s1
Observe que podemos usar o símbolo [He] para abreviar esta configuração; bem como [Ne] e [Ar]. Este último é o usado porque o argônio é o gás nobre que mais se aproxima do potássio. Portanto, sua configuração de elétrons do kernel se parece com:
[Ar] 4s1
indiano
O índio tem quarenta e nove elétrons, sendo sua configuração eletrônica completa:
1sdois 2sdois 2 P6 3sdois 3p6 4sdois 3d10 4p6 5sdois 4d10 5 p1
Como o criptônio é o gás nobre mais próximo que precede o índio, o símbolo [Kr] é usado para a abreviatura e temos sua configuração de elétron do kernel:
[Kr] 5sdois 4d10 5 p1
Embora os orbitais 4d não pertençam formalmente ao kernel do índio, seus elétrons não estão envolvidos (pelo menos em condições normais) em sua ligação metálica, mas sim nos orbitais 5s e 5p..
Tungstênio
O tungstênio (ou volfrâmio) tem 74 elétrons e sua configuração eletrônica completa é:
1sdois 2sdois 2 P6 3sdois 3p6 4sdois 3d10 4p6 5sdois 4d10 5 p6 6sdois 4f14 5 d4
Novamente, procuramos o gás nobre mais próximo que o precede. No seu caso, corresponde ao xenônio, que tem seus orbitais 5p completos. Portanto, substituímos a sequência de notações quânticas pelo símbolo [Xe] e, finalmente, teremos sua configuração eletrônica do kernel:
[Xe] 6sdois 4f14 5 d4
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Pat Thayer. (2016). Diagramas de configuração de elétrons. Recuperado de: chemicalapp.org
- Helmenstine, Anne Marie, Ph.D. (5 de dezembro de 2018). Definição do Núcleo de Gás Nobre. Recuperado de: thinkingco.com/
- Wikipedia. (2019). Configuração eletronica. Recuperado de: es.wikipedia.org



Ainda sem comentários