
Fatores de desnaturação de proteínas e consequências

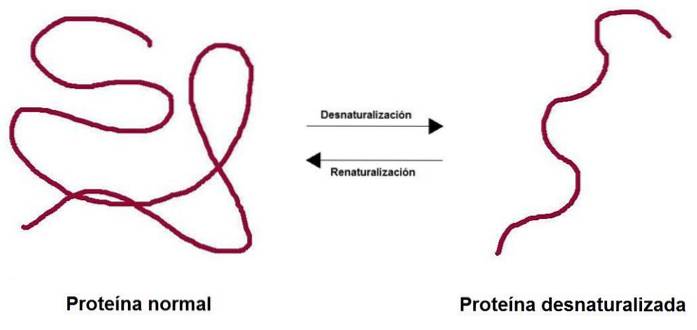
O desnaturação de proteína Consiste na perda da estrutura tridimensional devido a diversos fatores ambientais, como temperatura, pH ou determinados agentes químicos. A perda da estrutura resulta na perda da função biológica associada a essa proteína, seja ela enzimática, estrutural, transportadora, entre outras..
A estrutura da proteína é altamente sensível a mudanças. A desestabilização de uma única ligação de hidrogênio essencial pode desnaturar a proteína. Da mesma forma, existem interações que não são estritamente essenciais para cumprir a função da proteína e, se desestabilizadas, não têm efeito na função..
Índice do artigo
- 1 Estrutura das proteínas
- 1.1 Estrutura primária
- 1.2 Estrutura secundária
- 1.3 Estrutura terciária
- 1.4 Estrutura quaternária
- 2 Fatores que causam desnaturação
- 2,1 pH
- 2.2 Temperatura
- 2.3 Substâncias Químicas
- 2.4 Agentes redutores
- 3 consequências
- 3.1 Renaturação
- 4 proteínas chaperonas
- 5 referências
Estrutura da proteína
Para entender os processos de desnaturação de proteínas, devemos saber como as proteínas são organizadas. Estes apresentam estrutura primária, secundária, terciária e quaternária.
Estrutura primária
É a sequência de aminoácidos que compõe a referida proteína. Os aminoácidos são os blocos de construção fundamentais que compõem essas biomoléculas e existem 20 tipos diferentes, cada um com propriedades físicas e químicas específicas. Eles se ligam uns aos outros por meio de uma ligação peptídica.
Estrutura secundária
Nessa estrutura, essa cadeia linear de aminoácidos começa a se dobrar por meio de ligações de hidrogênio. Existem duas estruturas secundárias básicas: a hélice α, em forma de espiral; e a folha dobrada β, quando duas cadeias lineares estão alinhadas em paralelo.
Estrutura terciária
Envolve outros tipos de forças que resultam em dobras específicas da forma tridimensional.
As cadeias R dos resíduos de aminoácidos que compõem a estrutura da proteína podem formar pontes dissulfeto e as partes hidrofóbicas das proteínas aglomeram-se por dentro, enquanto as hidrofílicas ficam de frente para a água. As forças de van der Waals atuam como um estabilizador das interações descritas.
Estrutura quaternária
Consiste em agregados de unidades de proteína.
Quando uma proteína é desnaturada, ela perde sua estrutura quaternária, terciária e secundária, enquanto a primária permanece intacta. Proteínas ricas em ligações dissulfeto (estrutura terciária) proporcionam maior resistência à desnaturação.
Fatores que causam desnaturação
Qualquer fator que desestabilize as ligações não covalentes responsáveis pela manutenção da estrutura nativa da proteína pode causar sua desnaturação. Entre os mais importantes podemos citar:
pH
Em valores de pH muito extremos, sejam ácidos ou básicos, a proteína pode perder sua configuração tridimensional. Excesso de íons H+ e OH- no meio desestabiliza as interações de proteínas.
Essa mudança no padrão iônico causa desnaturação. A desnaturação por pH pode ser reversível em alguns casos e irreversível em outros.
Temperatura
A desnaturação térmica ocorre com o aumento da temperatura. Em organismos que vivem em condições ambientais médias, as proteínas começam a se desestabilizar em temperaturas acima de 40 ° C. Claramente, as proteínas de organismos termofílicos podem suportar essas faixas de temperatura..
Os aumentos de temperatura se traduzem em movimentos moleculares aumentados que afetam as ligações de hidrogênio e outras ligações não covalentes, resultando na perda da estrutura terciária..
Esses aumentos de temperatura levam a uma diminuição na taxa de reação, se estamos falando de enzimas.
Substancias quimicas
Substâncias polares - como a uréia - em altas concentrações afetam as ligações de hidrogênio. Da mesma forma, as substâncias não polares podem ter consequências semelhantes..
Os detergentes também podem desestabilizar a estrutura da proteína; no entanto, não é um processo agressivo e são geralmente reversíveis.
Agentes redutores
O Β-mercaptoetanol (HOCH2CH2SH) é um agente químico freqüentemente usado em laboratório para desnaturar proteínas. É responsável por reduzir as pontes dissulfeto entre os resíduos de aminoácidos. Pode desestabilizar a estrutura terciária ou quaternária da proteína.
Outro agente redutor com funções semelhantes é o ditiotreitol (DTT). Além disso, outros fatores que contribuem para a perda da estrutura nativa nas proteínas são os metais pesados em altas concentrações e a radiação ultravioleta..
Consequências
Quando ocorre a desnaturação, a proteína perde sua função. As proteínas funcionam de forma otimizada quando em seu estado nativo.
A perda de função nem sempre está associada a um processo de desnaturação. Pode ser que uma pequena mudança na estrutura da proteína leve à perda de função sem desestabilizar toda a estrutura tridimensional.
O processo pode ou não ser irreversível. No laboratório, se as condições forem revertidas, a proteína pode retornar à sua configuração inicial.
Renaturação
Um dos experimentos mais famosos e conclusivos de renaturação foi evidenciado na ribonuclease A.
Quando os pesquisadores adicionaram agentes desnaturantes como ureia ou β-mercaptoetanol, a proteína foi desnaturada. Se esses agentes fossem removidos, a proteína voltava à sua conformação nativa e poderia desempenhar sua função com 100% de eficiência..
Uma das conclusões mais importantes desta pesquisa foi demonstrar experimentalmente que a conformação tridimensional da proteína é dada por sua estrutura primária..
Em alguns casos, o processo de desnaturação é totalmente irreversível. Por exemplo, quando cozinhamos um ovo aplicamos calor às proteínas (a principal é a albumina) que o constituem, a clara assume um aspecto sólido e esbranquiçado. Intuitivamente, podemos concluir que, mesmo se o resfriarmos, ele não retornará à sua forma inicial.
Na maioria dos casos, o processo de desnaturação é acompanhado pela perda de solubilidade. Também reduz a viscosidade, a taxa de difusão e cristaliza mais facilmente..
Proteínas chaperonas
As proteínas chaperones ou chaperoninas são responsáveis por prevenir a desnaturação de outras proteínas. Eles também reprimem certas interações que não são adequadas entre as proteínas para garantir o dobramento correto das mesmas..
Quando a temperatura do meio aumenta, essas proteínas aumentam sua concentração e atuam prevenindo a desnaturação de outras proteínas. É por isso que também são chamadas de "proteínas de choque térmico" ou HSP por sua sigla em inglês. (Proteínas de choque térmico).
Chaperoninas são análogas a uma gaiola ou um barril que protege a proteína de interesse dentro.
Essas proteínas que respondem a situações de estresse celular foram relatadas em vários grupos de organismos vivos e são altamente conservadas. Existem diferentes classes de chaperoninas e são classificadas de acordo com seu peso molecular..
Referências
- Campbell, N. A., & Reece, J. B. (2007). biologia. Panamerican Medical Ed..
- Devlin, T. M. (2004). Bioquímica: livro didático com aplicações clínicas. Revertido.
- Koolman, J., & Röhm, K. H. (2005). Bioquímica: texto e atlas. Panamerican Medical Ed..
- Melo, V., Ruiz, V. M., & Cuamatzi, O. (2007). Bioquímica dos processos metabólicos. Reverter.
- Pacheco, D., & Leal, D. P. (2004). Bioquímica médica. Limusa editorial.
- Pena, A., Arroyo, A., Gómez, A., & Tapia, R. (1988). Bioquímica. Limusa editorial.
- Sadava, D., & Purves, W. H. (2009). Vida: A Ciência da Biologia. Panamerican Medical Ed..
- Tortora, G. J., Funke, B. R., & Case, C. L. (2007). Introdução à microbiologia. Panamerican Medical Ed..
- Voet, D., Voet, J. G., & Pratt, C. W. (2007). Fundamentos de Bioquímica. Panamerican Medical Ed..



Ainda sem comentários