
Processo de destilação simples e exemplos
O destilação simples é um procedimento em que os vapores produzidos a partir de um líquido são levados diretamente para um condensador, dentro do qual a temperatura dos vapores cai e ocorre sua condensação..
É usado para separar um componente volátil dos componentes não voláteis presentes em um líquido. Também é utilizado para a separação de dois líquidos presentes em uma solução com pontos de ebulição muito diferentes..
A destilação simples não é um método eficiente para a separação de dois líquidos voláteis presentes em uma solução. Quando a temperatura dela aumenta com o fornecimento de calor, a energia cinética das moléculas também aumenta, o que permite que elas superem a força de coesão entre elas..
Os líquidos voláteis começam a ferver quando sua pressão de vapor é igual à pressão externa exercida na superfície da solução. Ambos os líquidos contribuem para a composição do vapor formado, sendo maior o líquido mais volátil; ou seja, aquele com o ponto de ebulição mais baixo.
Portanto, o líquido mais volátil constitui a maior parte do destilado formado. O processo é repetido até que a pureza desejada ou a concentração mais alta possível seja alcançada..
Índice do artigo
- 1 Processo de destilação simples
- 1.1 Equipamento
- 1.2 Capacitor
- 1.3 Aquecimento
- 2 exemplos
- 2.1 Destilação de água e álcool
- 2.2 Separação líquido-sólido
- 2.3 Álcool e glicerina
- 3 referências
Processo de destilação simples
Na destilação simples, a temperatura de uma solução é aumentada até ferver. Nesse momento ocorre a transição entre os estados líquido e gasoso. Isso é observado quando um borbulhamento constante começa na solução.
Equipe
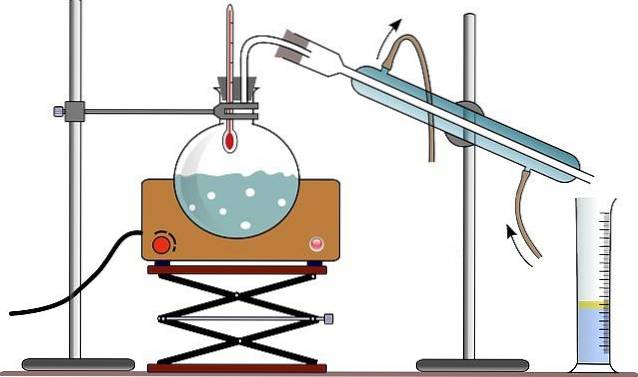
O equipamento para destilação simples geralmente consiste em um queimador ou manta de aquecimento (ver imagem); frasco redondo de vidro refratário com boca esmerilada, para permitir seu acoplamento; e algumas contas de vidro (algumas usam uma vara de madeira) para reduzir o tamanho das bolhas formadas.
As contas de vidro funcionam como núcleos formadores de bolhas, que permitem que o líquido ferva lentamente, evitando o superaquecimento que resulta na formação de uma espécie de bolhas gigantes; capaz até de expulsar uma massa de líquido do frasco de destilação.
Preso à boca do frasco está um adaptador de vidro refratário com três bocas, que são feitas de vidro fosco. Um gargalo é preso ao frasco de destilação, um segundo gargalo é conectado ao condensador e o terceiro gargalo é fechado usando uma rolha de borracha..
Na imagem, a montagem não tem este adaptador; e em vez disso, através da mesma rolha de borracha, o termômetro e um conector direto para o condensador são colocados.
Condensador
O condensador é um dispositivo concebido para cumprir a função que o seu nome indica: condensar o vapor que o atravessa. Pela boca superior é acoplado ao adaptador, e pela boca inferior é conectado a um balão onde são coletados os produtos da destilação..
No caso da imagem, eles usam (embora nem sempre seja correto) um cilindro graduado, para medir o volume destilado de uma vez.
A água que circula pela camisa externa do condensador, entra pela sua parte inferior e sai pela parte superior. Isso garante que a temperatura do condensador seja baixa o suficiente para permitir a condensação dos vapores produzidos no frasco de destilação..
Todas as peças que compõem o aparelho de destilação são fixadas por pinças conectadas a um suporte metálico.
Um volume da solução a ser destilada é colocado no frasco redondo com capacidade adequada..
As conexões adequadas são feitas usando grafite ou graxa para garantir uma vedação eficiente e o aquecimento da solução é iniciado. Simultaneamente, a passagem da água pelo condensador começa.
Aquecimento
À medida que o balão de destilação é aquecido, observa-se um aumento da temperatura no termômetro, até que se chega a um ponto em que a temperatura permanece constante. Isso permanece assim mesmo se o aquecimento continuar; a menos que todo o líquido volátil tenha evaporado completamente.
A explicação para este comportamento é que foi atingido o ponto de ebulição do componente com menor ponto de ebulição da mistura líquida, em que sua pressão de vapor é igual à pressão externa (760 mm de Hg).
Neste ponto, toda a energia térmica é gasta na mudança do estado líquido para o estado gasoso que envolve a expiração da força de coesão intermolecular do líquido. Portanto, o fornecimento de calor não se traduz em aumento de temperatura..
O produto líquido da destilação é coletado em frascos devidamente rotulados, cujos volumes dependerão do volume originalmente colocado no frasco de destilação..
Exemplos
Destilação de água e álcool
Você tem uma solução aquosa de álcool a 50%. Sabendo que o ponto de ebulição do álcool é 78,4 ° C e o ponto de ebulição da água é de aproximadamente 100 ° C, pode-se obter um álcool puro com uma simples destilação? A resposta é não.
Ao aquecer a mistura álcool-água, o ponto de ebulição do líquido mais volátil é inicialmente atingido; neste caso, álcool. O vapor formado terá uma proporção maior de álcool, mas também haverá uma alta presença de água no vapor, já que os pontos de ebulição são semelhantes..
O líquido coletado na destilação e condensação terá um percentual de álcool superior a 50%. Se este líquido for submetido a destilações sucessivas, uma solução concentrada de álcool pode ser obtida; mas não puro, uma vez que os vapores continuarão a arrastar a água até uma certa composição, formando o que é conhecido como um azeótropo
O produto líquido da fermentação de açúcares tem um percentual de álcool de 10%. Concentração essa que pode chegar a 50%, como no caso do Whisky, por destilação simples.
Separação líquido-sólido
Uma solução de sal em água consiste em um líquido que pode ser volatilizado e um composto não volátil com alto ponto de ebulição: sal..
Ao destilar a solução, a água pura pode ser obtida no líquido de condensação. Enquanto isso, no fundo do frasco de destilação os sais irão se depositar.
Álcool e glicerina
Existe uma mistura de álcool etílico, com ponto de ebulição de 78,4ºC, e glicerina, com ponto de ebulição de 260ºC. Quando submetido à destilação simples, o vapor formado terá um percentual muito alto de álcool, próximo a 100%..
Portanto, obter-se-á um líquido destilado com um percentual de álcool semelhante ao do vapor. Isso acontece porque os pontos de ebulição dos líquidos são muito diferentes.
Referências
- Claude Yoder. (2019). Destilação. Química com fio. Recuperado de: wiredchemist.com
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Dragani, Rachelle. (17 de maio de 2018). Três exemplos de misturas de destilação simples. Ciência. Recuperado de: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (2 de janeiro de 2019). O que é destilação? Definição de química. Recuperado de: Thoughtco.com
- Dr. Welder. (s.f.). Destilação simples. Recuperado de: dartmouth.edu
- Universidade de Barcelona. (s.f.). Destilação. Recuperado de: ub.edu

Ainda sem comentários