
Energia de ativação química Em que consiste, cálculo

O energia de ativação química (do ponto de vista dos estudos cinéticos) refere-se à menor quantidade possível de energia necessária para iniciar uma reação química. De acordo com a teoria das colisões na cinética química, todas as moléculas que estão em movimento têm uma certa quantidade de energia cinética.
Isso significa que quanto maior a velocidade de seu movimento, maior a magnitude de sua energia cinética. Nesse sentido, uma molécula que carrega um movimento rápido não pode ser dividida em fragmentos por si mesma, então uma colisão deve ocorrer entre ela e outra molécula para que uma reação química ocorra..
Quando isso acontece - quando há uma colisão entre as moléculas - uma fração de sua energia cinética é transformada em energia vibracional. Da mesma forma, se no início do processo a energia cinética for elevada, as moléculas que participam da colisão apresentarão uma vibração tão grande que algumas das ligações químicas presentes serão rompidas..
Essa quebra de ligações constitui o primeiro passo na transformação de reagentes em produtos; isto é, na formação destes. Ao contrário, se no início desse processo a energia cinética for de pequena magnitude, haverá um fenômeno de "rebote" das moléculas, por meio do qual se separarão praticamente intactas..
Índice do artigo
- 1 o que faz?
- 1.1 Complexo ativado
- 2 Como é calculado?
- 2.1 Cálculo da energia de ativação de uma reação química
- 3 Como a energia de ativação afeta a taxa de uma reação?
- 4 exemplos de cálculo de energia de ativação
- 5 referências
Em que consiste?
Partindo do conceito de colisões entre moléculas para iniciar as reações químicas anteriormente descritas, pode-se dizer que existe uma quantidade mínima de energia necessária para que uma colisão ocorra..
Portanto, se o valor da energia for menor que esse mínimo necessário, simplesmente não haverá alteração entre as moléculas após ocorrer a colisão, o que significa que quando essa energia estiver ausente, as espécies envolvidas permanecerão praticamente intactas e isso não ocorrerá. Qualquer alteração devido a este acidente.
Nessa ordem de ideias, a energia mínima necessária para que uma mudança ocorra após uma colisão entre as moléculas é chamada de energia de ativação..
Em outras palavras, as moléculas envolvidas em uma colisão devem possuir uma quantidade total de energia cinética igual ou maior que a energia de ativação para que uma reação química ocorra..
Da mesma forma, em muitos casos, as moléculas colidem e dão origem a uma nova espécie chamada de complexo ativado, uma estrutura que também é chamada de "estado de transição" porque existe apenas temporariamente..
É causada pela espécie reagente devido à colisão e antes da formação dos produtos de reação.
Complexo ativado
O complexo ativado mencionado acima forma uma espécie que tem estabilidade muito baixa, mas, por sua vez, possui uma grande magnitude de energia potencial..
O diagrama a seguir mostra a transformação dos reagentes em produtos, expressa em termos de energia e observando que a magnitude da energia do complexo ativado que se forma é consideravelmente maior do que a dos reagentes e produtos..
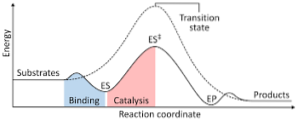
Se ao final da reação os produtos apresentarem uma estabilidade maior que as substâncias reagentes, a liberação de energia ocorre na forma de calor, dando origem a uma reação exotérmica..
Pelo contrário, se os reagentes resultam em uma estabilidade maior do que os produtos, significa que a mistura de reação manifesta uma absorção de energia na forma de calor de seu entorno, resultando em uma reação endotérmica..
Da mesma forma, se ocorrer um ou outro caso, deve-se construir um diagrama como o mostrado anteriormente, onde seja plotada a energia potencial do sistema que reage ao avanço ou progresso da reação..
Assim, são obtidas as mudanças de energia potencial que ocorrem à medida que a reação prossegue e os reagentes são transformados em produtos..
Como é calculado?
A energia de ativação de uma reação química está intimamente relacionada com a constante de velocidade da referida reação, e a dependência desta constante em relação à temperatura é representada pela equação de Arrhenius:
k = Ae-Ea / RT
Nesta expressão k representa a constante de velocidade da reação (que depende da temperatura) e o parâmetro PARA é chamado de fator de frequência e é uma medida da frequência de colisões entre moléculas.
Por sua parte, e expressa a base da série de logaritmos naturais. É elevado a uma potência igual ao quociente negativo da energia de ativação (Ea) entre o produto resultante da constante de gás (R) e temperatura absoluta (T) do sistema a considerar.
Deve-se notar que o fator de frequência pode ser considerado uma constante em certos sistemas de reação em uma ampla faixa de temperatura..
Essa expressão matemática foi originalmente suposta pelo químico holandês Jacobus Henricus van't Hoff em 1884, mas quem lhe deu validade científica e interpretou sua premissa foi o químico sueco Svante Arrhenius, em 1889.
Cálculo da energia de ativação de uma reação química
A equação de Arrhenius especifica a proporcionalidade direta que existe entre a constante de taxa de uma reação e a frequência de colisões entre as moléculas.
Da mesma forma, esta equação pode ser representada de uma forma mais conveniente aplicando a propriedade dos logaritmos naturais a cada lado da equação, obtendo:
ln k = ln A - Ea / RT
Reorganizando os termos em termos de obtenção da equação de uma reta (y = mx + b), a seguinte expressão é alcançada:
ln k = (- Ea / R) (1 / T) + ln A
Assim, ao construir um gráfico de ln k contra 1 / T, uma linha reta é obtida, onde ln k representa a coordenada e, (-Ea / R) representa a inclinação da linha (m), (1 / T) representa a coordenada x, e ln A representa a interceptação com o eixo das ordenadas (b).
Como pode ser visto, a inclinação resultante desse cálculo é igual ao valor de -Ea / R. Isso implica que, se se deseja obter o valor da energia de ativação por meio desta expressão, deve-se realizar um simples esclarecimento desta, resultando em:
Ea = -mR
Aqui, o valor de m é conhecido e R é uma constante igual a 8,314 J / K mol.
Como a energia de ativação afeta a taxa de uma reação??
Ao tentar obter uma imagem da energia de ativação, ela pode ser considerada uma barreira que não permite que uma reação ocorra entre as moléculas de menor energia..
Como em uma reação comum acontece que o número de moléculas que podem reagir é bastante grande, a velocidade - e de forma equivalente, a energia cinética dessas moléculas - pode ser muito variável.
Geralmente acontece que apenas uma pequena quantidade da totalidade das moléculas que sofrem uma colisão - aquelas que têm uma maior velocidade de movimento - têm energia cinética suficiente para poder ultrapassar a magnitude da energia de ativação. Então, essas moléculas são adequadas e capazes de fazer parte da reação.
De acordo com a equação de Arrhenius, o sinal negativo - que precede o quociente entre a energia de ativação e o produto da constante do gás e a temperatura absoluta - implica que a constante de taxa diminui à medida que há um aumento na energia de ativação, bem como um crescimento quando a temperatura aumenta.
Exemplos de cálculo de energia de ativação
Para calcular a energia de ativação através da construção de um gráfico, de acordo com a equação de Arrhenius, as constantes de velocidade para a reação de decomposição do acetaldeído foram medidas em cinco temperaturas diferentes e deseja-se determinar a energia de ativação para a reação, que é expressa como:
CH3CHO (g) → CH4(g) + CO (g)
Os dados para as cinco medições são os seguintes:
k (1 / M1/2S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700-730-760-790-810
Em primeiro lugar, para resolver esta incógnita e determinar a energia de ativação, deve-se construir um gráfico de ln k vs 1 / T (y vs x), para obter uma linha reta e daqui tomar a inclinação e encontrar o valor de Ea , como explicado.
Transformando os dados de medição, de acordo com a equação de Arrhenius [ln k = (- Ea / R) (1 / T) + ln A], os seguintes valores são encontrados para y e x, respectivamente:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
A partir desses valores e por meio do cálculo matemático da inclinação - seja em um computador ou em uma calculadora, por meio da expressão m = (Ydois-Y1) / (Xdois-X1) ou usando o método de regressão linear - é obtido que m = -Ea / R = -2,09 * 104 K. Assim:
Ea = (8,314 J / K mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 10dois kJ / mol
Para determinar outras energias de ativação através da forma gráfica, um procedimento semelhante é realizado.
Referências
- Wikipedia. (s.f.). Energia de ativação. Recuperado de en.wikipedia.org
- Chang, R. (2007). Química, nona edição. México: McGraw-Hill.
- Britannica, E. (s.f.). Energia de ativação. Obtido em britannica.com
- Moore, J. W. e Pearson, R. G. (1961). Cinética e mecanismo. Recuperado de books.google.co.ve
- Kaesche, H. (2003). Corrosão de Metais: Princípios Físico-Químicos e Problemas Atuais. Obtido em books.google.co.ve


Ainda sem comentários