
Equações de equilíbrio térmico, aplicações, exercícios
O equilíbrio térmico de dois corpos que estão em contato térmico é o estado que é alcançado após um tempo suficiente para que as temperaturas de ambos os corpos se equalizem.
Em termodinâmica, o contato térmico de dois corpos (ou dois sistemas termodinâmicos) é entendido como uma situação em que os corpos têm contato mecânico ou estão separados, mas em contato com uma superfície que só permite a passagem de calor de um corpo para outro (diatérmico superfície).
-

Figura 1. Depois de um tempo, o gelo e a bebida atingirão o equilíbrio térmico. Fonte: pixabay
No contato térmico não deve haver reação química entre os sistemas em contato. Deve haver apenas troca de calor.
Situações do cotidiano em que há troca de calor ocorrem com sistemas como a bebida gelada e o copo, o café quente e a colher de chá, ou o corpo e o termômetro, entre tantos outros exemplos..
Índice do artigo
- 1 Quando dois ou mais sistemas estão em equilíbrio térmico??
- 2 Equações de equilíbrio térmico
- 2.1 Temperatura de equilíbrio
- 2.2 Contato térmico com mudança de fase
- 3 aplicativos
- 3.1 - Exercício 1
- 4 exercícios resolvidos
- 4.1 - Exercício 2
- 4.2 Exercício 3
- 4.3 - Exercício 4
- 5 referências
Quando dois ou mais sistemas estão em equilíbrio térmico?
A segunda lei da termodinâmica afirma que o calor sempre vai do corpo com a temperatura mais alta para o corpo com a temperatura mais baixa. A transferência de calor cessa assim que as temperaturas se igualam e o estado de equilíbrio térmico é alcançado..
A aplicação prática do equilíbrio térmico é o termômetro. Um termômetro é um aparelho que mede sua própria temperatura, mas graças ao equilíbrio térmico podemos saber a temperatura de outros corpos, como a de uma pessoa ou animal.
O termômetro de coluna de mercúrio é colocado em contato térmico com o corpo, por exemplo sob a língua, e espera-se tempo suficiente para que o equilíbrio térmico entre o corpo e o termômetro seja alcançado e sua leitura não varie mais.
Quando este ponto é alcançado, a temperatura do termômetro é a mesma do corpo.
A lei zero da termodinâmica afirma que se um corpo A está em equilíbrio térmico com um corpo C e esse mesmo corpo C está em equilíbrio térmico com B, então A e B estão em equilíbrio térmico mesmo quando não há contato térmico entre A e B.
Portanto, concluímos que dois ou mais sistemas estão em equilíbrio térmico quando eles têm a mesma temperatura.
Equações de equilíbrio térmico
Assumimos um corpo A com temperatura inicial Ta em contato térmico com outro corpo B com temperatura inicial Tb. Também assumimos que Ta> Tb, então, de acordo com a segunda lei, o calor é transferido de A para B.
Depois de um tempo, o equilíbrio térmico será alcançado e ambos os corpos terão a mesma temperatura final Tf. Este terá um valor intermediário em Ta e Tb, ou seja, Ta> Tf> Tb.
A quantidade de calor Qa transferida de A para B será Qa = Ma Ca (Tf - Ta), onde Ma é a massa do corpo A, Ca a capacidade de calor por unidade de massa de A e (Tf - Ta) a diferença de temperatura. Se Tf for menor que Ta, então Qa é negativo, indicando que o corpo A desiste de calor.
Da mesma forma, para o corpo B, temos que Qb = Mb Cb (Tf - Tb); e se Tf for maior que Tb, então Qb é positivo, indicando que o corpo B recebe calor. Como o corpo A e o corpo B estão em contato térmico um com o outro, mas isolados do ambiente, a quantidade total de calor trocado deve ser zero: Qa + Qb = 0
Então Ma Ca (Tf - Ta) + Mb Cb (Tf - Tb) = 0
Temperatura de equilíbrio
Desenvolvendo esta expressão e resolvendo para a temperatura Tf a temperatura final de equilíbrio térmico é obtida.
-

Figura 2. Temperatura de equilíbrio final. Fonte: self made
Tf = (Ma Ca Ta + Mb Cb Tb) / (Ma Ca + Mb Cb).
Como um caso particular, considere o caso em que os corpos A e B são idênticos em massa e capacidade térmica, neste caso a temperatura de equilíbrio será:
Tf = (Ta + Tb) / 2 ↔ se Ma = Mb e Ca = Cb.
Contato térmico com mudança de fase
Em algumas situações acontece que quando dois corpos são colocados em contato térmico, a troca de calor provoca a mudança de estado ou fase em um deles. Se isso acontecer, deve-se levar em consideração que durante a mudança de fase não há mudança de temperatura no corpo que esteja modificando seu estado..
Caso ocorra a mudança de fase de algum dos corpos em contato térmico, é aplicado o conceito de calor latente L, que é a energia por unidade de massa necessária para a mudança de estado:
Q = L ∙ M
Por exemplo, para derreter 1 kg de gelo a 0 ° C são necessários 333,5 kJ / kg e este valor é o calor latente L de derretimento do gelo.
Durante o derretimento, ele muda de água sólida para água líquida, mas essa água mantém a mesma temperatura do gelo durante o processo de derretimento..
Formulários
O equilíbrio térmico faz parte da vida diária. Por exemplo, vamos examinar esta situação em detalhes:
-Exercício 1
Uma pessoa quer tomar banho em água morna a 25 ° C. Em um balde, coloque 3 litros de água fria a 15 ° C e na cozinha aqueça a água até 95 ° C.
Quantos litros de água quente você deve adicionar ao balde de água fria para ter a temperatura final desejada?
Solução
Suponha que A seja água fria e B seja água quente:
-
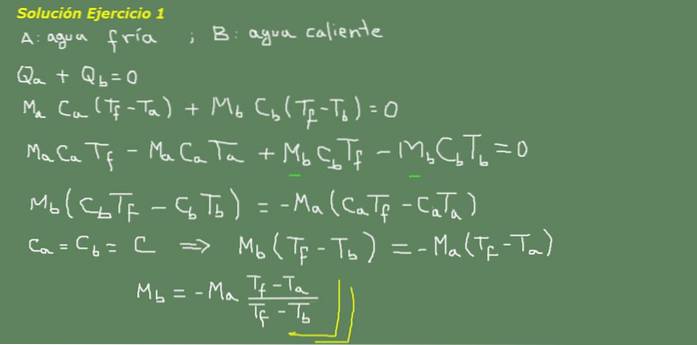
Figura 3. Solução para o exercício 3. Fonte: elaboração própria.
Propomos a equação de equilíbrio térmico, conforme indicado no quadro da figura 3 e a partir daí resolvemos para a massa de água Mb.
A massa inicial de água fria pode ser obtida porque a densidade da água é conhecida, que é de 1Kg por litro. Ou seja, temos 3 kg de água fria.
Ma = 3kg
Então
Mb = - 3 kg * (25 ° C - 15 ° C) / (25 ° C - 95 ° C) = 0,43 kg
Então, 0,43 litros de água quente é suficiente para finalmente obter 3,43 litros de água quente a 25 ° C.
Exercícios resolvidos
-Exercício 2
Uma peça de metal com massa de 150 ge temperatura de 95 ° C é introduzida em um recipiente contendo meio litro de água a uma temperatura de 18 ° C. Depois de um tempo o equilíbrio térmico é alcançado e a temperatura da água e do metal é de 25 ° C.
Suponha que o recipiente com a água e o pedaço de metal seja uma garrafa térmica fechada que não permite a troca de calor com o meio ambiente.
Obtenha o calor específico do metal.
Solução
Primeiro vamos calcular o calor absorvido pela água:
Qa = Ma Ca (Tf - Ta)
Qa = 500g 1cal / (g ° C) (25 ° C - 18 ° C) = 3500 calorias.
Esse é o mesmo calor fornecido pelo metal:
Qm = 150g Cm (25 ° C - 95 ° C) = -3500 calorias.
Assim, podemos obter a capacidade de calor do metal:
Cm = 3500 cal / (150g 70 ° C) = ⅓ cal / (g ° C).
Exercício 3
Você tem 250 c.c. de água a 30 ° C À água que está em uma garrafa térmica isolante, são adicionados 25g de cubos de gelo a 0 ° C, com a finalidade de resfriá-la.
Determine a temperatura de equilíbrio; ou seja, a temperatura que permanecerá depois que todo o gelo derreter e a água do gelo se aquecer para coincidir com a água no copo inicialmente.
Solução 3
Este exercício pode ser resolvido em três etapas:
- O primeiro é o derretimento do gelo que absorve o calor da água inicial para derreter e se tornar água..
- Em seguida, é calculada a queda de temperatura na água inicial, devido ao fato de ter desistido de calor (Qced<0) para fundir el hielo.
- Finalmente, a água derretida (vinda do gelo) deve ser balanceada termicamente com a água que existia inicialmente..
-

Figura 4. Solução para o exercício 3. Fonte: elaboração própria.
Vamos calcular o calor necessário para o derretimento do gelo:
Qf = L * Mh = 333,5 kJ / kg * 0,025kg = 8,338 kJ
Então, o calor fornecido pela água para derreter o gelo é Qced = -Qf
Este calor liberado pela água diminui sua temperatura para um valor T 'que podemos calcular da seguinte forma:
T '= T0 - Qf / (Ma * Ca) = 22,02 ° C
Onde Ca é a capacidade de calor da água: 4,18 kJ / (kg ° C).
Por fim, a massa original de água que agora está a 22,02 ° C cederá calor à massa de água derretida do gelo que está a 0 ° C..
Finalmente, a temperatura de equilíbrio Te será alcançada após tempo suficiente:
Te = (Ma * T '+ Mh * 0 ° C) / (Ma + Mh) = (0,25kg * 22,02 ° C + 0,025kg * 0 ° C) / (0,25kg + 0,025kg).
Finalmente, obtendo a temperatura de equilíbrio:
Te = 20,02 ° C.
-Exercício 4
Um pedaço de 0,5 kg de chumbo sai do forno a uma temperatura de 150 ° C, que está bem abaixo do seu ponto de fusão. Esta peça é colocada em um recipiente com 3 litros de água à temperatura ambiente de 20 ° C. Determine a temperatura de equilíbrio final.
Calcule também:
- Quantidade de calor fornecida pelo chumbo à água.
- Quantidade de calor absorvido pela água.
Dados:
Calor específico do chumbo: Cp = 0,03 cal / (g ° C); calor específico da água: Ca = 1 cal / (g ° C).
Solução
Primeiro, determinamos a temperatura de equilíbrio final Te:
Te = (Ma Ca Ta + Mp Cp Tp) / (Ma Ca + Mp Cp)
Te = 20,65 ° C
Então, a quantidade de calor liberada pelo chumbo é:
Qp = Mp Cp (Te - Tp) = -1,94 x 10³ cal.
A quantidade de calor absorvida pela água será:
Qa = Ma Ca (Te - Ta) = + 1,94x 10³ cal.
Referências
- Atkins, P. 1999. Physical Chemistry. Edições Omega.
- Bauer, W. 2011. Physics for Engineering and Sciences. Volume 1. Mc Graw Hill.
- Giancoli, D. 2006. Física: Princípios com Aplicações. 6º… Ed Prentice Hall.
- Hewitt, Paul. 2012. Ciência Física Conceitual. 5 ª. Ed. Pearson.
- Resnick, R. (1999). Fisica. Vol. 1. 3ª Ed. Em espanhol. Compañía Editorial Continental S.A. por C.V.
- Rex, A. 2011. Fundamentals of Physics. Pearson.
- Sears, Zemansky. 2016. Física Universitária com Física Moderna. 14º. Ed. Volume 1.
- Serway, R., Jewett, J. (2008). Física para Ciências e Engenharia. Volume 1. 7º. Ed. Cengage Learning.



Ainda sem comentários