
Propriedades de escala microscópica, contagem de partículas, exemplos
O escala microscópica É aquele usado para medir tamanhos e comprimentos que não podem ser vistos a olho nu e que têm menos de um milímetro de comprimento. Do mais alto ao mais baixo, as escalas microscópicas no sistema métrico são:
- O milímetro (1 mm), que é um décimo de centímetro ou um milésimo de metro. Nesta escala temos uma das maiores células do corpo, que é o óvulo, cujo tamanho é 1,5mm.
- O décimo de milímetro (0,1 mm). Esta é a escala da espessura ou diâmetro de um cabelo humano.
- O micrômetro ou mícron (1μm = 0,001 mm). Nesta escala estão células vegetais e animais e bactérias.
As células vegetais são da ordem de 100μm. As células animais são dez vezes menores, é da ordem de 10μm; enquanto as bactérias são 10 vezes menores do que as células animais e são da ordem de 1μm.
Índice do artigo
- 1 nanoescala
- 2 instrumentos para observação microscópica
- 3 propriedades microscópicas
- 3.1-A matéria é um vazio imenso
- 4 Como contar partículas em escala microscópica?
- 4.1 - Exemplo 1
- 4.2 - Exemplo 2
- 5 referências
Escala nanométrica
Existem medidas ainda menores do que a escala microscópica, mas não são comumente usadas, exceto em alguns contextos especiais. Aqui estão algumas das medições nanométricas mais importantes:
- O nanômetro (1 ηm = 0,001 μm = 0,000001 mm) é um milionésimo de milímetro. Nesta escala estão alguns vírus e moléculas. Os vírus são da ordem de 10ηm e as moléculas da ordem de 1ηm.
- O angstrom (1Å = 0,1ηm = 0,0001μm = 10-7milímetros). Esta medida forma a escala ou tamanho atômico.
- O fantasma (1fm = 0,00001Å = 0,000001ηm = 10-12milímetros). Essa é a escala dos núcleos atômicos, que são entre 10.000 e 100.000 vezes menores que o átomo. Porém, apesar de seu pequeno tamanho, o núcleo concentra 99,99% da massa atômica.
- Existem escalas menores para o núcleo atômico, uma vez que são constituídos por partículas como prótons e nêutrons. Mas há mais: essas partículas, por sua vez, são compostas de partículas mais fundamentais, como os quarks..
Instrumentos para observação microscópica
Quando os objetos estão entre as escalas milimétricas e micrométricas (1 mm - 0,001 mm), eles podem ser observados com um microscópio óptico.
No entanto, se os objetos ou estruturas estiverem entre nanômetros e Angstroms, serão necessários microscópios eletrônicos ou nanoscópios..
Na microscopia eletrônica, em vez de luz, são usados elétrons de alta energia que têm um comprimento de onda muito mais curto do que a luz. A desvantagem do microscópio eletrônico é que não é possível colocar amostras vivas nele porque funciona sob vácuo..
Em vez disso, o nanoscópio usa luz laser e tem a vantagem sobre a microscopia eletrônica de que as estruturas e moléculas dentro de uma célula viva podem ser observadas e registradas..
Nanotecnologia é a tecnologia com a qual circuitos, estruturas, peças e até motores são fabricados em escalas que vão do nanômetro à atômica.
Propriedades microscópicas
Na física, em uma primeira aproximação o comportamento da matéria e dos sistemas é estudado do ponto de vista macroscópico. A partir desse paradigma, a matéria é um continuum infinitamente divisível; e este ponto de vista é válido e adequado para muitas situações da vida cotidiana.
No entanto, alguns fenômenos no mundo macroscópico só podem ser explicados se as propriedades microscópicas da matéria forem levadas em consideração..
Do ponto de vista microscópico, a estrutura molecular e atômica da matéria é levada em consideração. Ao contrário da abordagem macroscópica, nesta escala há uma estrutura granular com lacunas e espaços entre moléculas, átomos e até mesmo dentro deles..
A outra característica do ponto de vista microscópico da física é que um pedaço de matéria, por menor que seja, é composto por um enorme número de partículas separadas umas das outras e em movimento contínuo..
-A matéria é um vazio imenso
Em um pequeno pedaço de matéria, a distância entre os átomos é enorme quando comparada ao seu tamanho, mas por sua vez os átomos são enormes quando comparados aos seus próprios núcleos, onde 99,99% da massa está concentrada..
Ou seja, um pedaço de matéria na escala microscópica é um enorme vácuo com concentrações de átomos e núcleos que ocupam uma minúscula fração do volume total. Nesse sentido, a escala microscópica é semelhante à escala astronômica..
De objetos macroscópicos à descoberta do átomo
Os primeiros químicos, que eram os alquimistas, perceberam que os materiais podiam ser de dois tipos: puros ou compostos. Assim, chegou-se à ideia de elementos químicos.
Os primeiros elementos químicos descobertos foram os sete metais da antiguidade: prata, ouro, ferro, chumbo, estanho, cobre e mercúrio. Com o tempo, mais foram descobertos, na medida em que foram encontradas substâncias que não podiam ser decompostas em outras.
Em seguida, os elementos foram classificados de acordo com suas propriedades e características em metais e não metais. Todos aqueles que tinham propriedades e afinidades químicas semelhantes foram agrupados em uma mesma coluna, surgindo assim a tabela periódica dos elementos..
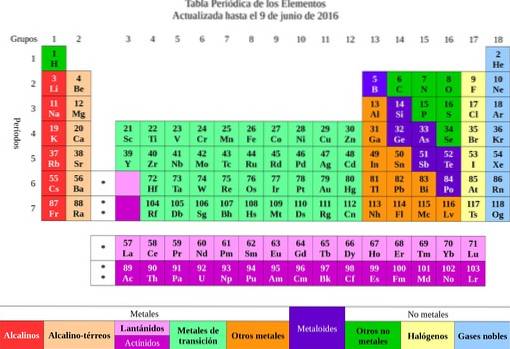
Dos elementos, foi passada a ideia de átomos, palavra que significa indivisível. Pouco tempo depois, os cientistas perceberam que os átomos tinham uma estrutura. Além disso, os átomos tinham dois tipos de carga elétrica (positiva e negativa).
Partículas subatômicas
Nos experimentos de Rutherford nos quais ele bombardeou os átomos de uma fina placa de ouro com partículas alfa, a estrutura do átomo foi revelada: um pequeno núcleo positivo rodeado por elétrons.
Os átomos continuaram a ser bombardeados com mais e mais partículas de energia e isso ainda está sendo feito, a fim de desvendar os segredos e propriedades do mundo microscópico em escala cada vez menor..
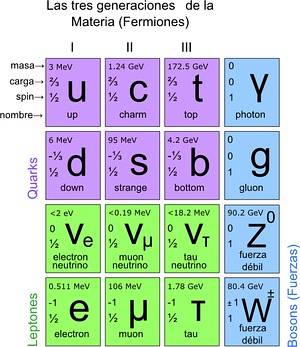
Dessa forma, chegou-se ao modelo padrão, no qual se estabelece que as verdadeiras partículas elementares são aquelas das quais os átomos são compostos. Por sua vez, os átomos dão origem a elementos, estes a compostos e a todas as interações conhecidas (exceto a gravitação). No total, são 12 partículas.
Essas partículas fundamentais também têm sua tabela periódica. Existem dois grupos: as partículas fermiônicas de ½ spin e as bosônicas. Os bósons são responsáveis pelas interações. Os fermiônicos são 12 e são aqueles que dão origem aos prótons, nêutrons e átomos.
Como contar partículas em escala microscópica?
Com o tempo, os químicos foram descobrindo as massas relativas dos elementos a partir de medições precisas em reações químicas. Assim, por exemplo, pode-se determinar que o carbono é 12 vezes mais pesado que o hidrogênio..
O hidrogênio também foi determinado como o elemento mais leve, então esse elemento foi atribuído à massa relativa 1.
Por outro lado, os químicos exigiam saber o número de partículas envolvidas em uma reação, para que nenhum reagente acabasse ou faltasse. Por exemplo, uma molécula de água requer dois átomos de hidrogênio e um átomo de oxigênio..
Destes antecedentes nasce o conceito de toupeira. Um mol de qualquer substância é um número fixo de partículas equivalente à sua massa molecular ou atômica em gramas. Assim, foi determinado que 12 gramas de carbono têm o mesmo número de partículas que 1 grama de hidrogênio. Esse número é conhecido como número de Avogadro: 6,02 x 10 ^ 23 partículas.
-Exemplo 1
Calcule quantos átomos de ouro existem em 1 grama de ouro.
Solução
O ouro é conhecido por ter um peso atômico de 197. Esses dados podem ser encontrados na tabela periódica e indicam que um átomo de ouro é 197 vezes mais pesado que um de hidrogênio e 197/12 = 16.416 vezes mais pesado que o carbono..
Uma mole de ouro tem 6,02 × 10 ^ 23 átomos e tem o peso atômico expresso em gramas, ou seja, 197 gramas.
Em um grama de ouro existem 1/197 moles de ouro, ou seja 6,02 × 10 ^ 23 átomos / 197 = 3,06 x10 ^ 23 átomos de ouro.
-Exemplo 2
Determine o número de moléculas de carbonato de cálcio (CaCO3) que estão em 150 gramas desta substância. Diga também quantos átomos de cálcio, quantos carbono e quantos oxigênio há neste composto.
Solução
A primeira coisa é determinar a massa molecular do carbonato de cálcio. A tabela periódica indica que o cálcio tem um peso molecular de 40 g / mol, carbono 12 g / mol e oxigênio 16 g / mol..
Em seguida, a massa molecular de (CaCO3) vai ser :
40 g / mol + 12 g / mol + 3 x 16 g / mol = 100 g / mol
Cada 100 gramas de carbonato de cálcio equivale a 1 mol. Então, em 150 gramas, eles correspondem a 1,5 moles.
Cada mol de carbonato tem 6,02 x 10 ^ 23 moléculas de carbonato, então em 1,5 moles de carbonato existem 9,03 x 10 ^ 23 moléculas.
Resumindo, em 150 gramas de carbonato de cálcio existem:
- 9,03 x 10 ^ 23 moléculas de carbonato de cálcio.
- Átomos de cálcio: 9,03 x 10 ^ 23 .
- Também 9,03 x 10 ^ 23 átomos de carbono
- Por último, 3 x 9,03 x 10 ^ 23 átomos de oxigênio = 27,09 x 10 ^ 23 átomos de oxigênio.
Referências
- Biologia aplicada. Quais são as medidas microscópicas? Recuperado de: youtube.com
- Educação Química. Representações macroscópicas, submicroscópicas e simbólicas da matéria. Recuperado de: scielo.org.mx.
- García A. Curso de física interativa. Macroestados, microestados. Temperatura, entropia. Recuperado de: sc.ehu.es
- A estrutura microscópica da matéria. Recuperado de: alipso.com
- Wikipedia. Nível microscópico. Recuperado de: wikipedia.com



Ainda sem comentários