
Estrutura da estrutura cristalina, tipos e exemplos
O estrutura de cristal É um dos estados sólidos que átomos, íons ou moléculas podem adotar na natureza, que se caracteriza por ter um alto ordenamento espacial. Ou seja, é uma evidência da “arquitetura corpuscular” que define muitos corpos com aspecto vítreo e brilhante..
O que promove ou qual força é responsável por essa simetria? As partículas não estão sozinhas, mas interagem umas com as outras. Essas interações consomem energia e afetam a estabilidade dos sólidos, de forma que as partículas procuram se acomodar para minimizar essa perda de energia..

Portanto, suas naturezas intrínsecas os levam a se colocarem no arranjo espacial mais estável. Por exemplo, pode ser aquele em que as repulsões entre íons com as mesmas cargas são mínimas, ou onde alguns átomos - como os metálicos - também ocupam o maior volume possível em suas embalagens..
A palavra "cristal" tem um significado químico que pode ser mal representado por outros corpos. Quimicamente, refere-se a uma estrutura ordenada (microscopicamente) que, por exemplo, pode consistir em moléculas de DNA (um cristal de DNA).
No entanto, é popularmente mal utilizado para se referir a qualquer objeto ou superfície vítrea, como espelhos ou garrafas. Ao contrário dos cristais verdadeiros, o vidro consiste em uma estrutura amorfa (desordenada) de silicatos e muitos outros aditivos..
Índice do artigo
- 1 Estrutura
- 1.1 Célula unitária
- 2 tipos
- 2.1 De acordo com seu sistema cristalino
- 2.2 De acordo com sua natureza química
- 3 exemplos
- 3.1 K2Cr2O7 (sistema triclínico)
- 3.2 NaCl (sistema cúbico)
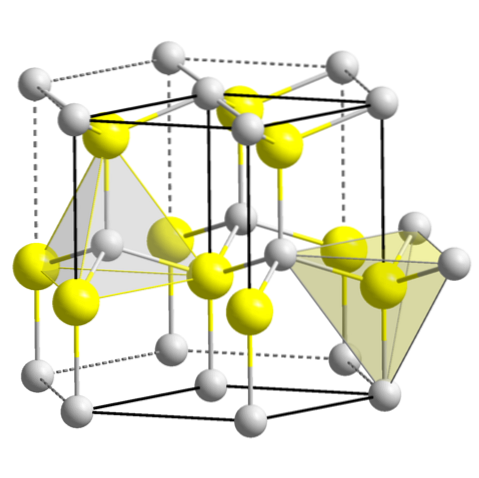
- 3,3 ZnS (wurtzita, sistema hexagonal)
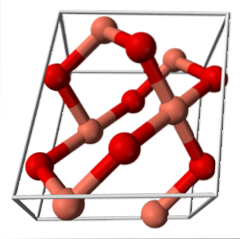
- 3.4 CuO (sistema monoclínico)
- 4 referências
Estrutura
Na imagem acima, algumas joias de esmeralda são ilustradas. Assim como esses, muitos outros minerais, sais, metais, ligas e diamantes exibem uma estrutura cristalina; mas, que relação seu ordenamento tem com a simetria?
Se um cristal, cujas partículas podem ser observadas a olho nu, são aplicadas operações de simetria (invertê-lo, girá-lo em ângulos diferentes, refleti-lo em um plano, etc.), então será verificado que ele permanece intacto em todas as dimensões do espaço..
O oposto ocorre para um sólido amorfo, do qual diferentes ordens são obtidas submetendo-o a uma operação de simetria. Além disso, carece de padrões de repetição estrutural, o que mostra a aleatoriedade na distribuição de suas partículas..
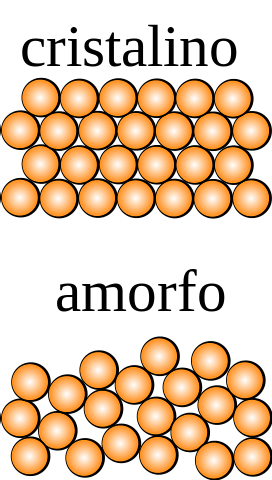
Qual é a menor unidade que compõe o padrão estrutural? Na imagem superior, o sólido cristalino é simétrico no espaço, enquanto o amorfo não é..
Se quadrados fossem desenhados que envolvessem esferas laranja e operações de simetria fossem aplicadas a eles, seria descoberto que eles geram outras partes do cristal.
O acima é repetido com quadrados cada vez menores, até encontrar aquele que é assimétrico; o que o precede em tamanho é, por definição, a célula unitária.
Célula unitária
A célula unitária é a expressão estrutural mínima que permite a reprodução completa do sólido cristalino. A partir disso é possível montar o vidro, movendo-o em todas as direções do espaço.
Pode ser considerada uma pequena gaveta (baú, balde, recipiente, etc.) onde as partículas, representadas por esferas, são colocadas seguindo um padrão de enchimento. As dimensões e geometrias desta caixa dependem dos comprimentos dos seus eixos (a, b e c), bem como dos ângulos entre eles (α, β e γ).
A mais simples de todas as células unitárias é a da estrutura cúbica simples (imagem superior (1)). Neste, o centro das esferas ocupa os cantos do cubo, quatro na base e quatro no teto..
Nesse arranjo, as esferas ocupam apenas 52% do volume total do cubo, e como a natureza abomina o vácuo, poucos compostos ou elementos adotam essa estrutura..
Porém, se as esferas estiverem dispostas no mesmo cubo de forma que uma ocupe o centro (cúbica centrada no corpo, bcc), então haverá um empacotamento mais compacto e eficiente (2). Agora as esferas ocupam 68% do volume total.
Por outro lado, em (3) nenhuma esfera ocupa o centro do cubo, mas o centro de suas faces, e todas elas ocupam até 74% do volume total (cúbica centrada na face, cc).
Assim, pode-se observar que para um mesmo cubo outros arranjos podem ser obtidos, variando a forma como as esferas são empacotadas (íons, moléculas, átomos, etc.).
Tipos
As estruturas cristalinas podem ser classificadas de acordo com seus sistemas cristalinos ou a natureza química de suas partículas..
Por exemplo, o sistema cúbico é o mais comum de todos e muitos sólidos cristalinos são governados por ele; No entanto, esse mesmo sistema se aplica a cristais iônicos e metálicos..
De acordo com seu sistema cristalino
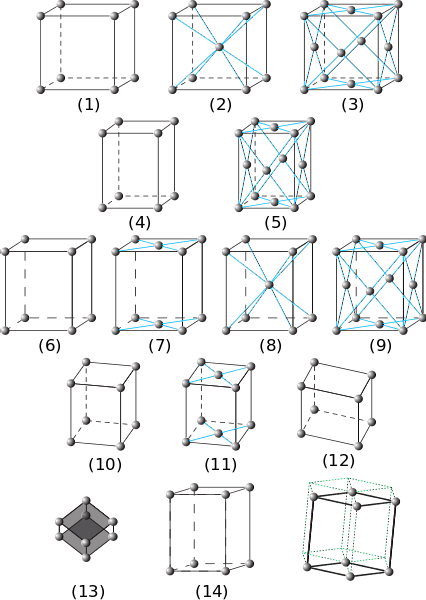
Na imagem anterior, os sete principais sistemas de cristal estão representados. Percebe-se que são quatorze, na verdade, que são produtos de outras formas de embalagens para os mesmos sistemas e compõem as redes Bravais..
De (1) a (3) são cristais com sistemas de cristal cúbico. Em (2) observa-se (pelas listras azuis) que a esfera do centro e a dos cantos interagem com oito vizinhos, portanto as esferas têm um número de coordenação 8. E em (3) o número de coordenação é 12 ( para vê-lo, você precisa duplicar o cubo em qualquer direção).
Os elementos (4) e (5) correspondem a sistemas tetragonais simples e centrados na face. Ao contrário do cúbico, seu eixo c é mais longo do que os eixos a e b.
De (6) a (9) estão os sistemas ortorrômbicos: desde os simples e centrados nas bases (7), aos centrados no corpo e nas faces. Nestes α, β e γ são 90º, mas todos os lados são de comprimentos diferentes.
As figuras (10) e (11) são os cristais monoclínicos e (12) são os triclínicos, esta última apresentando desigualdades em todos os seus ângulos e eixos..
O elemento (13) é o sistema romboédrico, análogo ao cúbico, mas com ângulo γ diferente de 90º. Finalmente, existem os cristais hexagonais
Os deslocamentos dos elementos (14) originam o prisma hexagonal traçado pelas linhas pontilhadas verdes.
De acordo com sua natureza química
- Se os cristais são feitos de íons, então eles são cristais iônicos presentes em sais (NaCl, CaSO4, CuCldois, KBr, etc.)
- Moléculas como a glicose formam (sempre que podem) cristais moleculares; neste caso, os famosos cristais de açúcar.
- Os átomos cujas ligações são essencialmente covalentes formam cristais covalentes. Esses são os casos de diamante ou carboneto de silício.
- Além disso, metais como ouro formam estruturas cúbicas compactas, que constituem cristais metálicos..
Exemplos
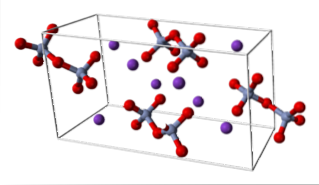
KdoisCrdoisOU7 (sistema triclínico)
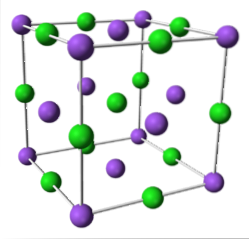
NaCl (sistema cúbico)
ZnS (wurtzita, sistema hexagonal)
CuO (sistema monoclínico)
Referências
- Quimitube. (2015). Por que "cristais" não são cristais. Obtido em 24 de maio de 2018, em: quimitube.com
- Pressbooks. 10.6 Estruturas reticuladas em sólidos cristalinos. Obtido em 26 de maio de 2018, em: opentextbc.ca
- Centro de Recursos Acadêmicos do Crystal Structures. [PDF]. Obtido em 24 de maio de 2018, em: web.iit.edu
- Ming. (30 de junho de 2015). Tipos Estruturas de Cristal. Obtido em 26 de maio de 2018, em: crystalvisions-film.com
- Helmenstine, Anne Marie, Ph.D. (31 de janeiro de 2018). Tipos de Cristais. Obtido em 26 de maio de 2018, em: Thoughtco.com
- KHI. (2007). Estruturas Cristalinas. Obtido em 26 de maio de 2018, em: folk.ntnu.no
- Paweł Maliszczak. (25 de abril de 2016). Cristais de esmeralda em bruto do Vale de Panjshir, Afeganistão. [Figura]. Obtido em 24 de maio de 2018, em: commons.wikimedia.org
- Napy1kenobi. (26 de abril de 2008). Treliças Bravais. [Figura]. Obtido em 26 de maio de 2018, em: commons.wikimedia.org
- Usuário: Sbyrnes321. (21 de novembro de 2011). Cristalino ou amorfo. [Figura]. Obtido em 26 de maio de 2018, em: commons.wikimedia.org



Ainda sem comentários