
Propriedades do etilenoglicol, estrutura química, usos
O etilenoglicol é o composto orgânico mais simples da família do glicol. Sua fórmula química é CdoisH6OUdois, enquanto sua fórmula estrutural é HOCHdois-CHdoisOH. Um glicol é um álcool caracterizado por ter dois grupos hidroxila (OH) ligados a dois átomos de carbono vizinhos em uma cadeia alifática.
O etilenoglicol é um líquido límpido, incolor e inodoro. Na imagem abaixo você tem uma amostra dele em uma jarra. Além disso, tem um sabor adocicado e é muito higroscópico. É um líquido ligeiramente volátil, por isso exerce uma pressão de vapor muito pequena, com a densidade do vapor sendo maior do que a densidade do ar..

O etilenoglicol é um composto com ótima solubilidade em água, além de ser miscível com diversos compostos orgânicos; tais como álcoois alifáticos de cadeia curta, acetona, glicerol, etc. Isso se deve à sua capacidade de doar e aceitar ligações de hidrogênio de solventes próticos (que têm H).
O etilenoglicol polimeriza em muitos compostos, cujos nomes são freqüentemente abreviados para PEG e um número que indica seu peso molecular aproximado. O PEG 400, por exemplo, é um polímero líquido relativamente pequeno. Enquanto os grandes PEGs são sólidos brancos com uma aparência oleosa.
A propriedade do etilenoglicol de diminuir o ponto de fusão e aumentar o ponto de ebulição da água, permite seu uso como refrigerante e anticoagulante em veículos, aviões e equipamentos de informática.
Índice do artigo
- 1 propriedades
- 1.1 Nomes
- 1,2 massa molar
- 1.3 Aparência física
- 1.4 Odor
- 1.5 Sabor
- 1.6 Densidade
- 1.7 Ponto de fusão
- 1.8 ponto de ebulição
- 1.9 Solubilidade em água
- 1.10 Solubilidade em outros solventes
- 1,11 ponto de fulgor
- 1,12 Densidade de vapor
- 1.13 Pressão de vapor
- 1.14 Decomposição
- 1,15 Temperatura de armazenamento
- 1,16 Calor de combustão
- 1.17 Calor de vaporização
- 1.18 Tensão superficial
- 1,19 Índice de refração
- 1.20 Constante de dissociação
- 1,21 pH
- 1.22 Coeficiente de partição octanol / água
- 2 Estrutura química
- 3 Produção
- 3.1 Oxidação de etileno
- 3.2 Hidrólise de óxido de etileno
- 3.3 Processo Omega
- 4 usos
- 4.1 Refrigerante e anticongelante
- 4.2 Desidratação
- 4.3 Fabricação de polímeros
- 4.4 Explosivos
- 4.5 Proteção de madeira
- 4.6 Outros aplicativos
- 5 Envenenamento e riscos
- 5.1 Sintomas de exposição
- 5.2 Danos por ingestão
- 5.3 Consequências ecológicas do etilenoglicol
- 6 referências
Propriedades
Nomes
Etano-1,2-diol (IUPAC), etilenoglicol, monoetilenoglicol (MEG), 1-2-di-hidroxietano.
Massa molar
62,068 g / mol
Aparência física
Líquido claro, incolor e viscoso.
Odor
Banheiro
Gosto
Doce
Densidade
1,1132 g / cm3
Ponto de fusão
-12,9 ºC
Ponto de ebulição
197,3 ºC
Solubilidade em água
Miscível com água, composto altamente higroscópico.
Solubilidade em outros solventes
Miscível com álcoois alifáticos inferiores (metanol e etanol), glicerol, ácido acético, acetona e cetonas semelhantes, aldeídos, piridina, bases de alcatrão de carvão e solúvel em éter. Praticamente insolúvel em benzeno e seus homólogos, hidrocarbonetos clorados, éter de petróleo e óleos.
ponto de ignição
111 ºC
Densidade do vapor
2,14 em relação ao ar tomado como 1.
Pressão de vapor
0,092 mmHg a 25 ° C (por extrapolação).
Decomposição
Quando aquecido até a decomposição, emite fumaça acre e irritante.
Temperatura de armazenamento
2-8 ºC
Calor de combustão
1.189,2 kJ / mol
Calor da vaporização
50,5 kJ / mol
Tensão superficial
47,99 mN / m a 25 ºC
Índice de refração
1,4318 a 20 ºC
Constante de dissociação
pKa = 14,22 a 25 ºC
pH
6 a 7,5 (100 g / L de água) a 20 ºC
Coeficiente de partição octanol / água
Log P = - 1,69
Estrutura química
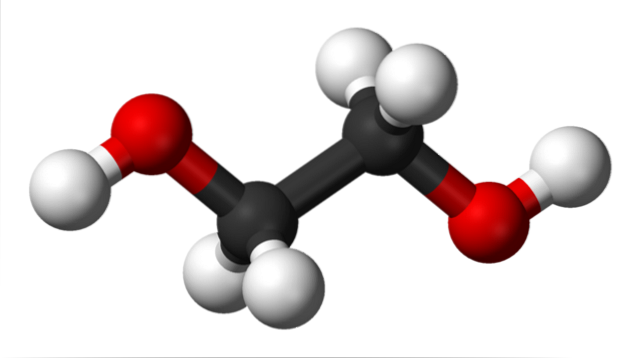
Na imagem superior temos a molécula de etilenoglicol representada por um modelo de esferas e barras. As esferas pretas correspondem aos átomos de carbono, que constituem seu esqueleto C-C, e em suas extremidades temos as esferas vermelha e branca para os átomos de oxigênio e hidrogênio, respectivamente..
É uma molécula simétrica e à primeira vista pode-se pensar que tem um momento de dipolo permanente; no entanto, suas ligações C-OH giram, o que favorece o dipolo. É também uma molécula dinâmica, que sofre rotações e vibrações constantes, e é capaz de formar ou receber ligações de hidrogênio graças aos seus dois grupos OH..
Na verdade, essas interações são responsáveis pelo etilenoglicol ter um ponto de ebulição tão alto (197 ºC).
Quando a temperatura cai para -13 ºC, as moléculas coalescem em um cristal ortorrômbico, onde os rotâmeros desempenham um papel importante; ou seja, existem moléculas que têm seus grupos O-H orientados em diferentes direções.
Produção
Oxidação de etileno
A etapa inicial na síntese do etilenoglicol é a oxidação do etileno em óxido de etileno. No passado, o etileno reagia com ácido hipocloroso para produzir clorohidrina. Este foi então tratado com hidróxido de cálcio para produzir óxido de etileno..
O método da clorohidrina não é muito lucrativo e um método de oxidação direta do etileno na presença de ar ou oxigênio foi trocado, usando óxido de prata como catalisador..
Hidrólise de óxido de etileno
A hidrólise do óxido de etileno (EO) com água sob pressão produz uma mistura bruta. A mistura de água-glicol é evaporada e reciclada, separando o monoetilenoglicol do dietilenoglicol e trietilenoglicol por destilação fracionada..
A reação de hidrólise de óxido de etileno pode ser descrita da seguinte forma:
CdoisH4O + HdoisO => OH-CHdois-CHdois-OH (etilenoglicol ou monoetilenoglicol)
A Mitsubishi Chemical desenvolveu um processo catalítico, por meio do uso de fósforo, na conversão de óxido de etileno em monoetilenoglicol.
Processo ômega
No processo Omega, o óxido de etileno é inicialmente convertido em carbonato de etileno, por meio de sua reação com o dióxido de carbono (COdois) Em seguida, o carbonato de etileno é submetido a uma hidrólise catalítica para obter o monoetilenoglicol com 98% de seletividade.
Existe um método relativamente novo para a síntese de etilenoglicol. Isso consiste na carbonilação oxidativa do metanol em oxalato de dimetila (DMO) e sua subsequente hidrogenação em etilenoglicol..
Formulários
Refrigerante e anticongelante
A mistura do etilenoglicol com água permite uma diminuição do ponto de congelamento e um aumento do ponto de ebulição, permitindo que os motores dos automóveis não congelem no inverno, nem superaquecem no verão..
Quando a porcentagem de etilenoglicol na mistura com água atinge 70%, o ponto de congelamento é de -55 ºC, então a mistura etilenoglicol-água pode ser utilizada como líquido de resfriamento e proteção contra congelamento nas condições em que pode ocorrer.
As baixas temperaturas de congelamento das soluções de etilenoglicol permitem seu uso como anticongelante em motores de automóveis; degelo de asas de aeronaves; e no degelo dos pára-brisas.
Também é utilizado para preservar amostras biológicas preservadas em baixas temperaturas, evitando assim a formação de cristais que podem danificar a estrutura das amostras..
O alto ponto de ebulição permite que soluções de etilenoglicol sejam usadas para manter baixas temperaturas em dispositivos ou equipamentos que geram calor durante a operação, como: automóveis, equipamentos de informática, ar condicionado, etc..
Desidratação
O etilenoglicol é um composto bastante higroscópico, o que tem permitido seu uso no tratamento de gases extraídos do subsolo com alto teor de vapores de água. A eliminação da água dos gases naturais favorece seu uso eficiente nos respectivos processos industriais..
Fabricação de Polímeros
O etilenoglicol é utilizado para a síntese de polímeros, como o polietilenoglicol (PEG), o tereftalato de polietileno (PET) e o poliuretano. PEGs são uma família de polímeros usados em aplicações como: espessamento de alimentos, tratamento de constipação, cosméticos, etc..
O PET é utilizado na produção de todos os tipos de embalagens descartáveis, que são utilizadas em diversos tipos de bebidas e alimentos. O poliuretano é utilizado como isolante térmico em refrigeradores e como enchimento em diversos tipos de móveis.
Explosivos
É utilizado na fabricação de dinamite, permitindo que por ter uma diminuição no ponto de congelamento da nitroglicerina, possa ser armazenada com menor risco..
Proteção de madeira
O etilenoglicol é utilizado no tratamento da madeira para protegê-la do apodrecimento, produzido pela ação de fungos. Isso é importante para a preservação das obras de arte do museu.
Outros aplicativos
O etilenoglicol está presente em meios para suspender sais condutores em capacitores eletrolíticos e em estabilizadores de espuma de soja. Também é utilizado na fabricação de plastificantes, elastômeros e ceras sintéticas.
O etilenoglicol é usado na separação de hidrocarbonetos aromáticos e parafínicos. Além disso, é utilizado na fabricação de detergentes para equipamentos de limpeza. Aumenta a viscosidade e diminui a volatilidade da tinta, tornando-a mais fácil de usar.
Além disso, o etilenoglicol pode ser usado na fundição de areia de moldagem e como um lubrificante durante a moagem de vidro e cimento. Também é usado como ingrediente em fluidos de frenagem hidráulica e como intermediário na síntese de ésteres, éteres, fibras de poliéster e resinas..
Entre as resinas em que o etilenoglicol é utilizado como matéria-prima está a alquídica, utilizada como base de tintas alquídicas, aplicada em tintas automotivas e arquitetônicas..
Envenenamento e riscos
Sintomas de exposição
O etilenoglicol apresenta baixa toxicidade aguda quando atua por contato com a pele ou por inalação. Porém, sua toxicidade se manifesta plenamente quando ingerido, sendo indicada como dose fatal de etilenoglicol de 1,5 g / kg de peso corporal, ou 100 mL para um adulto de 70 kg..
A exposição aguda ao etilenoglicol produz os seguintes sintomas: a inalação causa tosse, tontura e dor de cabeça. Na pele, por contato com etilenoglicol, ocorre ressecamento. Enquanto isso, nos olhos, produz vermelhidão e dor.
Dano de ingestão
A ingestão de etilenoglicol se manifesta por dor abdominal, náusea, inconsciência e vômito. Uma ingestão excessiva de etilenoglicol tem um efeito prejudicial no sistema nervoso central (SNC), na função cardiovascular e na morfologia e fisiologia dos rins..
Devido a falhas no funcionamento do SNC, ocorre paralisia ou movimento irregular dos olhos (nistagmo). No sistema cardiopulmonar, ocorre hipertensão, taquicardia e possível insuficiência cardíaca. Existem alterações graves no rim, produto da intoxicação com etilenoglicol.
Dilatação, degeneração e deposição de oxalato de cálcio ocorrem nos túbulos renais. Este último é explicado pelo seguinte mecanismo: o etilenoglicol é metabolizado pela enzima desidrogenase láctica para produzir glicoaldeído.
O glicoaldeído dá origem aos ácidos glicólico, glioxílico e oxálico. O ácido oxálico precipita-se rapidamente com o cálcio para formar oxalato de cálcio, cujos cristais insolúveis se depositam nos túbulos renais, produzindo alterações morfológicas e disfunções nos mesmos, podendo levar à insuficiência renal..
Devido à toxicidade do etilenoglicol, ele tem sido substituído gradativamente, em algumas de suas aplicações, pelo propilenoglicol.
Consequências ecológicas do etilenoglicol
Los aviones durante su deshielo liberan cantidades importantes de etilenglicol, que terminan acumuladas en las pistas de aterrizajes, las cuales al ser lavadas produce que el agua traslade el etilenglicol, a través del sistema de drenado, hacia los ríos donde su toxicidad afecta la vida de os peixes.
Mas a toxicidade do etilenoglicol não é em si a principal causa dos danos ecológicos. Durante sua biodegradação aeróbia, uma quantidade significativa de oxigênio é consumida, causando sua diminuição nas águas superficiais.
Por outro lado, sua biodegradação anaeróbia pode liberar substâncias tóxicas para os peixes, como acetaldeído, etanol, acetato e metano..
Referências
- Wikipedia. (2019). Etilenoglicol. Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. Banco de dados PubChem. (2019). 1,2-Etanodiol. CID = 174. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Etilenoglicol: Estrutura, Fórmula e Usos. Estudar. Recuperado de: study.com
- Leroy G. Wade. (27 de novembro de 2018). Etilenoglicol. Encyclopædia Britannica. Recuperado de: britannica.com
- A. Dominic Fortes e Emmanuelle Suard. (2011). Estruturas de cristal de etilenoglicol e monohidrato de etilenoglicol. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 de dezembro de 2010). Processo de produção e fabricação de etilenoglicol (EG). Recuperado de: icis.com
- Lucy Bell Young. (2019). Quais são os usos do etilenoglicol? Reagente. Recuperado de: chemical.co.uk
- QuimiNet. (2019). Origem, tipos e aplicações dos etilenoglicóis. Recuperado de: quiminet.com
- R. Gomes, R. Liteplo, & M.E. Manso. (2002). Etilenoglicol: Aspectos da saúde humana. Organização Mundial de Saúde Genebra. [PDF]. Recuperado de: who.int



Ainda sem comentários