
Fator de compressibilidade como calcular, exemplos e exercícios
O fator de compressibilidade Z, ou fator de compressão para gases, é um valor adimensional (sem unidades) que é introduzido como uma correção na equação de estado dos gases ideais. Desta forma, o modelo matemático se assemelha mais ao comportamento observado do gás..
No gás ideal, a equação de estado que se relaciona com as variáveis P (pressão), V (volume) e T (temperatura) é: P.V ideal = n.R.T com n = número de moles e R = constante de gás ideal. Adicionando a correção para o fator de compressibilidade Z, esta equação torna-se:
P.V = Z.n.R.T
Índice do artigo
- 1 Como calcular o fator de compressibilidade?
- 2 exemplos
- 2.1 O fator de compressibilidade em gases ideais, ar, hidrogênio e água
- 3 exercícios resolvidos
- 3.1 Exercício 1
- 3.2 Exercício 2
- 4 referências
Como calcular o fator de compressibilidade?
Levando em consideração que o volume molar é Vfrio = V / n, temos o volume molar real:
P . Vreal = Z. R. T → Z = PV real/ RT
Uma vez que o fator de compressibilidade Z depende das condições do gás, ele é expresso em função da pressão e temperatura:
Z = Z (P, T)
Comparando as duas primeiras equações, pode-se ver que se o número de mols n for igual a 1, o volume molar de um gás real está relacionado ao do gás ideal por:
Vreal / Videal = Z → V real = Z Videal
Quando a pressão ultrapassa 3 atmosferas, a maioria dos gases deixa de se comportar como gases ideais e o volume real difere significativamente do ideal.
Isso foi realizado em seus experimentos pelo físico holandês Johannes Van der Waals (1837-1923), o que o levou a criar um modelo mais adequado a resultados práticos do que a equação de gás ideal: a equação de estado de Van..
Exemplos
De acordo com a equação P.Vreal= Z.n.RT, Para um gás ideal, Z = 1. No entanto, em gases reais, conforme a pressão aumenta, também aumenta o valor de Z. Isso faz sentido porque quanto maior a pressão as moléculas de gás têm mais oportunidades de colidir, portanto, as forças repulsivas aumentam e com ele o volume.
Por outro lado, em pressões mais baixas, as moléculas se movem com mais liberdade e as forças repulsivas diminuem. Portanto, um volume menor é esperado. Quanto à temperatura, quando aumenta, Z diminui.
Como observou Van der Waals, nas proximidades do chamado ponto crítico, o comportamento do gás se desvia muito daquele de um gás ideal..
O ponto crítico (Tc, Pc) de qualquer substância são os valores de pressão e temperatura que determinam seu comportamento antes de uma mudança de fase:
-Tc é a temperatura acima da qual o gás em questão não se liquefaz.
-Pc é a pressão mínima necessária para liquefazer o gás na temperatura Tc
Cada gás possui seu ponto crítico, porém, definindo a temperatura e a pressão reduzida Tr E Pr da seguinte forma:
Pr = P / Pc
Vr = V / Vc
Tr = T / Tc
Observa-se que um gás confinado com idêntica Vr Y Tr exerce a mesma pressão Pr. Por este motivo, se Z for plotado como uma função de Pr para si mesmo Tr, cada ponto dessa curva é o mesmo para qualquer gás. Isso é chamado princípio dos estados correspondentes.
O fator de compressibilidade em gases ideais, ar, hidrogênio e água
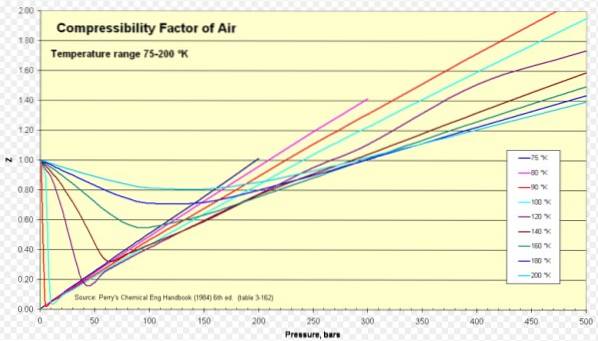
Abaixo está uma curva de compressibilidade para vários gases em várias temperaturas reduzidas. Aqui estão alguns exemplos de Z para alguns gases e um procedimento para encontrar Z usando a curva.
Gases ideais
Gases ideais têm Z = 1, conforme explicado no início.
Ar
Para o ar, Z é aproximadamente 1 em uma ampla faixa de temperaturas e pressões (ver figura 1), onde o modelo de gás ideal dá resultados muito bons.
Hidrogênio
Z> 1 para todas as pressões.
Água
Para encontrar Z para a água, você precisa dos valores do ponto crítico. O ponto crítico da água é: Pc = 22,09 MPa e Tc= 374,14 ° C (647,3 K). Novamente, deve-se levar em consideração que o fator de compressibilidade Z depende da temperatura e da pressão..
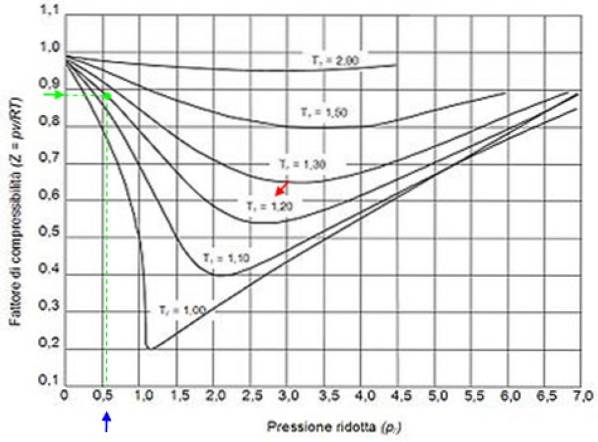
Por exemplo, suponha que você queira encontrar Z de água a 500 ºC e 12 MPa. Então, a primeira coisa a fazer é calcular a temperatura reduzida, para a qual os graus Celsius devem ser convertidos em Kelvin: 50 ºC = 773 K:
Tr = 773 / 647,3 = 1,2
Pr = 12 / 22,09 = 0,54
Com estes valores colocamos no gráfico da figura a curva correspondente a Tr = 1,2, indicado por uma seta vermelha. Em seguida, procuramos o valor de P no eixo horizontalr mais próximo de 0,54, marcado em azul. Agora desenhamos uma vertical até interceptarmos a curva Tr = 1,2 e finalmente projeta-se desse ponto para o eixo vertical, onde lemos o valor aproximado de Z = 0,89.
Exercícios resolvidos
Exercício 1
Existe uma amostra de gás à temperatura de 350 K e pressão de 12 atmosferas, com volume molar 12% maior que o previsto pela lei dos gases ideais. Calcular:
a) Fator de compressão Z.
b) Volume molar de gás.
c) De acordo com os resultados anteriores, indique quais são as forças dominantes nesta amostra de gás.
Dados: R = 0,082 L.atm / mol.K
Solução para
Sabendo que V real é 12% maior que Videal :
Vreal = 1,12 Videal
Z = V real / Videal = 1,12
Solução b
P. Vreal = Z. R. T → Vreal = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Solução c
As forças repulsivas são as que predominam, visto que o volume da amostra aumentou.
Exercício 2
São 10 moles de etano confinados em um volume de 4,86 L a 27 ºC. Encontre a pressão exercida pelo etano de:
a) O modelo de gás ideal
b) A equação de van der Waals
c) Encontre o fator de compressão dos resultados anteriores.
Dados para etano
Coeficientes de Van der Waals:
a = 5.489 dm6. atm. toupeira-dois e b = 0,06380 dm3. toupeira-1.
Pressão crítica: 49 atm. Temperatura crítica: 305 K
Solução para
A temperatura é passada para Kelvin: 27 º C = 27 +273 K = 300 K, lembre-se também que 1 litro = 1 L = 1 dm3.
Em seguida, os dados fornecidos são substituídos na equação do gás ideal:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 L) atm = 50,6 atm
Solução b
A equação de estado de Van der Waals é:
Onde aeb são os coeficientes dados pela afirmação. Ao limpar P:
Solução c
Calculamos a pressão e temperatura reduzidas:
Pr = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
Com esses valores, procuramos o valor de Z no gráfico da figura 2, descobrindo que Z é de aproximadamente 0,7.
Referências
- Atkins, P. 1999. Physical Chemistry. Edições Omega.
- Cengel, Y. 2012. Thermodynamics. 7mãe Edição. Colina Mcgraw.
- Engel, T. 2007. Introdução à Física Química: Termodinâmica. Pearson.
- Levine, I. 2014. Principles of Physico -ochemical. 6º. Edição. Colina Mcgraw.
- Wikipedia. Fator de compressibilidade. Recuperado de: en.wikipedia.org.


Ainda sem comentários