
Estrutura, propriedades, usos do fluoreto de cálcio (CaF2)
O fluoreto de cálcio É um sólido inorgânico formado por um átomo de cálcio (Ca) e dois átomos de flúor (F). Sua fórmula química é CaFdois e é um sólido branco-acinzentado cristalino.
Na natureza, é encontrado no mineral fluorita ou fluorita. Existe naturalmente nos ossos e dentes. O mineral fluorita é a principal fonte utilizada para a obtenção de outros compostos de flúor..

Além disso, o CaFdois É usado na prevenção de cáries nos dentes, por isso é adicionado a materiais usados pelos dentistas para curá-los. Na verdade, o fluoreto de cálcio também é adicionado à água potável (água que pode ser bebida) para que a população se beneficie da ingestão e da escovação dos dentes..
O CaFdois É usado na forma de grandes cristais em equipamentos ópticos e câmeras. Ele também é usado em pequenos dispositivos que são usados para detectar o quanto uma pessoa foi exposta à radioatividade.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Índice de refração
- 3.7 Solubilidade
- 3.8 Propriedades químicas
- 4 Presença na natureza
- 5 usos
- 5.1 - Na obtenção de compostos de flúor
- 5.2 - No cuidado dos dentes
- 5.3 - Em lentes para equipamentos ópticos
- 5.4 - Na indústria metalúrgica
- 5.5 - Em detectores de radioatividade ou radiação perigosa
- 5.6 - Outros usos
- 6 referências
Estrutura
Fluoreto de cálcio CaFdois é um composto iônico formado por um cátion cálcio Cadois+ e dois ânions de flúor F-. Porém, algumas fontes de informação indicam que seus links possuem um certo caráter covalente.
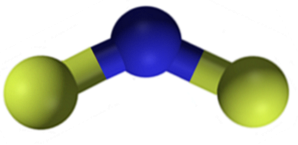
Nomenclatura
Fluoreto de cálcio
Propriedades
Estado físico
Sólido incolor a branco acinzentado com estrutura cristalina cúbica.
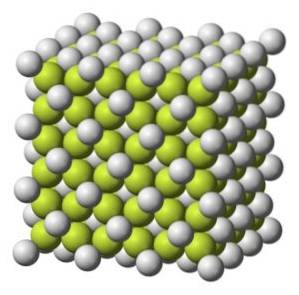
Peso molecular
78,07 g / mol
Ponto de fusão
1418 ºC
Ponto de ebulição
2533 ºC
Densidade
3,18 g / cm3 a 20 ° C.
Índice de refração
1,4328
Solubilidade
É insolúvel em água a 20 ° C. Quase insolúvel a 25 ° C: 0,002 g / 100 mL de água. Ligeiramente solúvel em ácidos.
Propriedades quimicas
Suas propriedades oxidantes ou redutoras são muito fracas, entretanto, essas reações podem ocorrer. Embora, em geral, em poucos casos.
É inerte a produtos químicos orgânicos e muitos ácidos, incluindo o ácido fluorídrico HF. Dissolve-se lentamente em ácido nítrico HNO3.
Não é inflamável. Não reage rapidamente com ar ou água.
Devido à sua baixa afinidade pela água, mesmo que seja exposta a um alto percentual de umidade, não a afeta mesmo por até um mês em temperatura ambiente normal..
Na presença de umidade, as paredes de seus cristais se dissolvem lentamente em temperaturas acima de 600 ° C. Em ambientes secos, pode ser usado até cerca de 1000 ° C sem ser afetado de forma apreciável.
Presença na natureza
Fluoreto de cálcio CaFdois encontrado naturalmente no mineral fluorita ou espatoflúor.
Embora o CaFdois puro é incolor o mineral fluorita, muitas vezes é colorido pela presença de elétrons presos nos "buracos" da estrutura cristalina.
Este mineral é altamente valorizado por seu brilho vítreo e variedade de cores (roxo, azul, verde, amarelo, incolor, marrom, rosa, preto e laranja avermelhado). Diz-se que é "o mineral mais colorido do mundo".





O fluoreto de cálcio também é encontrado nos ossos em quantidades entre 0,2 e 0,65%, e também no esmalte dos dentes em 0,33-0,59%..
Formulários
- Na obtenção de compostos de flúor
O mineral fluorita CaFdois É a fonte básica ou majoritária de flúor em todo o mundo. É a matéria-prima para a preparação de quase todos os compostos de flúor.
O mais importante deles é o ácido fluorídrico HF, a partir do qual os outros compostos fluorados são preparados. O íon fluoreto F- liberado do mineral reagindo-o com ácido sulfúrico concentrado HdoisSW4:
CaFdois (sólido) + HdoisSW4 (líquido) → CaSO4 (sólido) + 2 HF (gás)
- No cuidado dos dentes
Fluoreto de cálcio CaFdois é um agente para a prevenção de cáries. É usado para fluoretar água potável (água que pode ser bebida) para este fim.
Além disso, as baixas concentrações de flúor F- (na ordem de 0,1 partes por milhão) usados em cremes dentais e enxaguatórios bucais demonstraram ter um profundo efeito positivo no cuidado odontológico preventivo de cáries.

Nanopartículas de CaFdois mais efetivo
Embora os fluoretos sejam usados em cremes dentais e lavagens, a baixa concentração de cálcio (Ca) na saliva significa que os depósitos de CaF não se formam.dois nos dentes o mais eficazmente possível.
É por isso que foi inventada uma maneira de obter o pó de CaF.dois como nanopartículas.
Para isso, é utilizado um secador spray (do inglês spray secador) onde duas soluções (uma de hidróxido de cálcio Ca (OH)dois e um de fluoreto de amônio NH4F) são misturados enquanto são pulverizados em uma câmara com fluxo de ar quente.
Em seguida, ocorre a seguinte reação:
Ca (OH)dois + NH4F → CaFdois (sólido) + NH4Oh
NH4OH volatiliza como NH3 e HdoisOu e as nanopartículas de CaF permanecemdois.
Estes possuem alta reatividade e maior solubilidade, o que os torna mais eficazes para remineralizar dentes e como anticáries..
- Em lentes para equipamentos ópticos
O fluoreto de cálcio é usado para construir elementos ópticos, como prismas e janelas de espectrofotômetros de luz infravermelha e ultravioleta (UV)..
Esses dispositivos nos permitem medir a quantidade de luz absorvida por um material quando ele passa por ele.
O CaFdois é transparente nessas regiões do espectro de luz, tem um índice de refração extremamente baixo e permite uma resolução mais eficiente do que o NaCl na faixa de 1500-4000 cm.-1.
Graças à sua estabilidade química, pode resistir a condições adversas, razão pela qual os elementos ópticos CaFdois eles não são atacados. Ele também tem uma alta dureza.
Nas câmeras
Alguns fabricantes de câmeras usam lentes CaFdois cristalizado artificialmente para reduzir a dispersão de luz e alcançar excelente correção de distorção de cor.

- Na indústria metalúrgica
O CaFdois É utilizado como fundente na indústria metalúrgica, por ser fonte de cálcio insolúvel em água e, portanto, eficaz em aplicações sensíveis ao oxigênio..
É usado para fundir e processar ferro e aço na forma líquida. Isso se baseia no fato de ter um ponto de fusão semelhante ao do ferro e também de dissolver óxidos e metais..
- Em detectores de radioatividade ou radiação perigosa
O CaFdois é um material termoluminescente. Isso significa que ele pode absorver radiação nos elétrons de sua estrutura cristalina e, posteriormente, quando aquecido, liberá-la na forma de luz..
Essa luz emitida pode ser medida por um sinal elétrico. Este sinal é proporcional à quantidade de radiação que o material recebeu. Isso significa que quanto maior a quantidade de radiação recebida, maior a quantidade de luz que emitirá após ser aquecida..
Por este motivo, o CaFdois É usado nos chamados dosímetros pessoais, que são usados por pessoas que estão expostas a radiações perigosas e querem saber quanta radiação receberam em um determinado período de tempo.
- Outros usos
- É usado como um catalisador em reações químicas de desidratação e desidrogenação para a síntese de compostos orgânicos.
- É usado em eletrodos de soldagem alcalinos. Uma solda mais forte é obtida do que com eletrodos de ácido. Esses eletrodos são úteis na fabricação de navios e vasos de aço de alta pressão..
- Como um suplemento dietético em quantidades extremamente baixas (ppm ou partes por milhão).

Referências
- Pirmoradian, M. e Hooshmand, T. (2019). Remineralização e capacidades antibacterianas de nanocompósitos dentais à base de resina. Síntese e caracterização de fluoreto de cálcio (CaFdois) Em Aplicações de Materiais Nanocompósitos em Odontologia. Recuperado de sciencedirect.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Fluoreto de cálcio. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Weman, K. (2012). Soldagem a arco manual de metal (MMA) com eletrodos revestidos. In Welding Processes Handbook (Segunda Edição). Recuperado de sciencedirect.com.
- Hanning, M. e Hanning, C. (2013). Nanobiomateriais em Odontologia Preventiva. Fluoreto de cálcio nanométrico. In Nanobiomaterials in Clinical Dentistry. Recuperado de sciencedirect.com.
- Ropp, R.C. (2013). Grupo 17 (H, F, Cl, Br, I) Compostos Alcalinos Terrestres. Fluoreto de cálcio. Em Encyclopedia of the Alkaline Earth Compounds. Recuperado de sciencedirect.com.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Valkovic, V. (2000). Medições de radioatividade. Em Radioatividade no Meio Ambiente. Detectores termoluminescentes (TLDs). Recuperado de sciencedirect.com.



Ainda sem comentários