
Estrutura, propriedades e usos do fluoreto de potássio (KF)
O Fluoreto de Potássio É um haleto inorgânico que consiste em um sal formado entre o metal e o halogênio. Sua fórmula química é KF, o que significa que para cada cátion K+ há um F- contrapartida. Como pode ser visto, as interações são eletrostáticas e, como resultado, não há ligações K-F covalentes..
Este sal caracteriza-se pela sua extrema solubilidade em água, razão pela qual forma hidratos, absorve a humidade e é deliquescente. Portanto, é muito fácil preparar soluções aquosas dele, que servem como fonte de ânions de flúor para todas aquelas sínteses onde se deseja incorporá-lo em alguma estrutura.
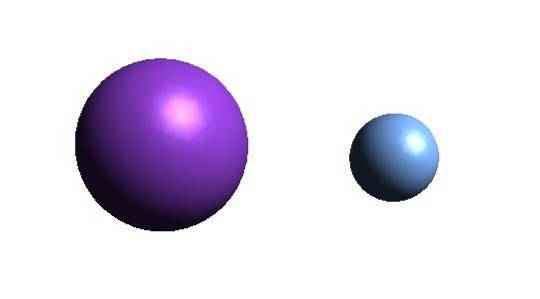
Acima está o cátion K+ (esfera roxa) e o ânion F- (esfera azulada). Ambos os íons interagem atraindo um ao outro por suas cargas +1 e -1.
Embora KF não seja tão perigoso quanto HF, o fato de ter o ânion F-, o torna um sal tóxico. É por isso que suas soluções têm sido usadas como inseticidas.
KI é produzido pela reação de carbonato de potássio com ácido fluorídrico, produzindo bifluoreto de potássio (KHFdois); que por decomposição térmica acaba dando origem ao fluoreto de potássio.
Índice do artigo
- 1 Estrutura do fluoreto de potássio
- 1.1 Hidratos
- 2 propriedades
- 2.1 Peso molecular
- 2.2 Aparência física (cor)
- 2.3 Sabor
- 2.4 Ponto de ebulição
- 2.5 Ponto de fusão
- 2.6 Solubilidade
- 2.7 Solubilidade em água
- 2.8 Densidade
- 2.9 Pressão de vapor
- 2.10 Decomposição
- 2.11 Ação corrosiva
- 2.12 Ponto de fulgor
- 2.13 Índice de refração experimental (ηD)
- 2.14 Estabilidade
- 3 usos
- 3.1 Ajustar pH
- 3.2 Fonte de flúor
- 3.3 Síntese de fluorocarbonos
- 3.4 Fluoração
- 3.5 Vários
- 4 referências
Estrutura do fluoreto de potássio
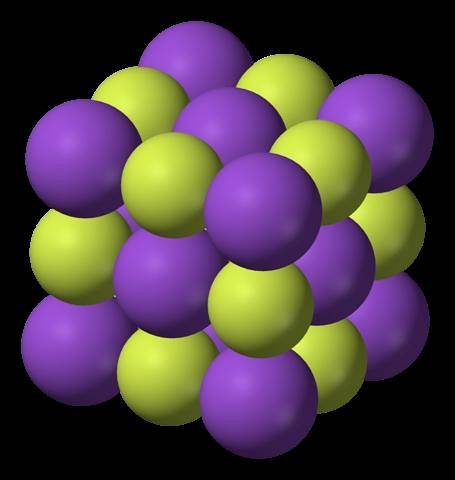
A imagem superior mostra a estrutura do fluoreto de potássio. As esferas roxas, como na primeira imagem, representam os cátions K+; enquanto as esferas amareladas representam os ânions F-.
Observe que o arranjo é cúbico e corresponde a uma estrutura semelhante a um sal-gema, muito semelhante à do cloreto de sódio. Todas as esferas são rodeadas por seis vizinhos, que constituem um octaedro KF6 ou FK6; ou seja, cada K+ envolve-se com seis F-, e o mesmo acontece vice-versa.
Foi mencionado anteriormente que o KF é higroscópico e, portanto, absorve umidade do ambiente. Sendo assim, o arranjo mostrado corresponderia à forma anidra (sem água) e não aos seus hidratos; que absorvem tanta água que até se solubilizam e "derretem" (deliquescência).
Hidratos
As estruturas cristalinas dos hidratos tornam-se menos simples. Por quê? Porque agora as moléculas de água intervêm diretamente nos arranjos e interagem com os íons K+ e F-. Um dos hidratos mais estáveis é KF2HdoisO e KF 4HdoisOU.
Em ambos os hidratos, os octaedros mencionados são deformados pelas moléculas de água. Isso se deve principalmente às ligações de hidrogênio entre o F- e o HdoisDE--HOH). Estudos cristalográficos determinaram que, apesar disso, os dois íons continuam a ter o mesmo número de vizinhos.
Como resultado de tudo isso, a estrutura cúbica original do fluoreto de potássio anidro torna-se um arranjo monoclínico e até romboédrico..
Os anidros compartilham a propriedade deliquescente, de modo que seus cristais brancos, se deixados em contato com uma névoa fria, se tornariam aquosos em pouco tempo..
Propriedades
Peso molecular
58,097 g / mol.
Aparência física (cor)
Cristais cúbicos brancos ou pó cristalino branco deliquescente.
Gosto
Sabor salgado forte.
Ponto de ebulição
2.741 ° F a 760 mmHg (1502 ° C). No estado líquido, torna-se um condutor de eletricidade, embora os ânions F- não colabore no mesmo grau que o K+.
Ponto de fusão
1.576 ° F; 858 ° C; 1131 K (KF anidro). Isso é indicativo de suas fortes ligações iônicas..
Solubilidade
Solúvel em HF, mas insolúvel em álcool. Isso mostra que as ligações de hidrogênio entre fluoreto e álcoois, F--HOR, não favorecem o processo de solvatação frente à dissolução de sua rede cristalina.
Solubilidade em água
92 g / 100 ml anidro (18 ° C); 102 g / 100 ml (25 ° C); di-hidrato 349,3 g / 100 ml (18 ° C). Ou seja, à medida que o KF é hidratado, ele se torna mais solúvel em água..
Densidade
2,48 g / cm3.
Pressão de vapor
100 kPa (750 mmHg) a 1.499 ºC.
Decomposição
Quando aquecido até a decomposição, emite uma fumaça tóxica de óxido de potássio e fluoreto de hidrogênio..
Ação corrosiva
Uma solução aquosa corrói o vidro e a porcelana.
Ponto de inflamação
Não é uma substância inflamável
Índice de refração experimental (ηD)
1.363.
Estabilidade
Estável se protegido da umidade, caso contrário, o sólido se dissolverá. Incompatível com ácidos e bases fortes.
Formulários
Ajustar pH
Soluções aquosas de fluoreto de potássio são usadas em aplicações e processos industriais; Por exemplo, as soluções KF permitem que o pH seja ajustado na fabricação em instalações de processamento têxtil e em lavanderias (aproximam-se de um valor de 7).
Fonte de flúor
O fluoreto de potássio é depois do fluoreto de hidrogênio, a principal fonte de obtenção de flúor. Esse elemento é utilizado em usinas nucleares e na produção de compostos inorgânicos e orgânicos, alguns com aplicações como incorporação em dentifrícios..
Síntese de fluorocarbonos
O fluoreto de potássio pode ser usado na síntese de fluorocarbono ou fluorocarbono a partir do clorocarbono, usando a reação de Finkeisteína. Etilenoglicol e dimetilsulfóxido são usados como solventes nesta reação..
Fluoração
Por ser uma fonte de flúor dissolvido em água, fluoretos complexos podem ser sintetizados a partir de suas soluções; ou seja, um F é adicionado a eles- às estruturas. Um exemplo está na seguinte equação química:
MnBrdois(ac) + 3KF (ac) => KMnF3(s) + 2KBr (ac)
Fluoreto de mistura KMnF então precipita3. Assim, F- de modo que é parte de um sal metálico complexo. Além do manganês, fluoretos de outros metais podem ser precipitados: KCoF3, KFeF3, KNiF3, KCuF3 e KZnF3.
Da mesma forma, o flúor pode ser incorporado covalentemente em um anel aromático, sintetizando organofluoretos.
Vários
KF é usado como um intermediário ou matéria-prima para a síntese de compostos que são usados principalmente em produtos agroquímicos ou pesticidas..
Além disso, é utilizado como fundente para soldas e corrosão de vidro; ou seja, sua solução aquosa corrói a superfície do vidro e, em um molde, imprime o acabamento desejado.
Referências
- Livro Químico. (2017). Fluoreto de Potássio. Recuperado de: chemicalbook.com
- PubChem. (2019). Fluoreto de Potássio. Recuperado de: pubchem.ncbi.nlm.nih.gov
- T. H. Anderson e E. C. Lincafelte. (1951). A estrutura do di-hidrato de fluoreto de potássio. Acta Cryst. 4, 181.
- Royal Society of Chemistry. (2015). Fluoreto de Potássio. ChemSpider. Recuperado de: chemspider.com
- Maquimex. (s.f.). Fluoreto de Potássio. Recuperado de: maquimex.com



Ainda sem comentários