
Estrutura do fosfato de sódio, propriedades, síntese, usos

O Fosfato de sódio é um sal inorgânico cuja fórmula química é Na3PO4. Também é chamado de fosfato trissódico (TSP): Fosfato trissódico), ou fosfato de sódio tribásico, porque carece completamente da capacidade de doar íons de hidrogênio H+.
Quando referido de forma plural, fosfatos de sódio, refere-se a todo o compêndio de sais, hidratados ou não, oriundos das interações eletrostáticas entre Na+ e o PO43-. Alguns desses sais até consistem em pirofosfatos de sódio, ou polímeros inorgânicos que possuem PO43- como monômero.

É por isso que, a menos que uma especificação seja feita, sempre se referirá ao Na3PO4, e não NaHdoisPO4, NadoisHPO4, N / D4PdoisOU7 nem a qualquer outro sal.
A imagem acima mostra a aparência do fosfato de sódio, que apresenta cristais brancos semelhantes ao sal comum ou de mesa, ou é adquirido como um pó branco de aparência amorfa. Então uma3PO4 é capaz de formar vários hidratos, sendo Na3PO412hdoisOu aquele que é mais comercializado.
É utilizado principalmente na indústria alimentícia, em detergentes, suplementos esportivos e serve como laxante hiperosmótico.
Índice do artigo
- 1 Estrutura química
- 2 propriedades
- 2.1 Aparência física
- 2.2 Ponto de fusão
- 2.3 Ponto de ebulição
- 2.4 Solubilidade em água
- 2,5 Densidade
- 2.6 Estabilidade
- 2,7 pH
- 3 Síntese
- 4 usos
- 4.1 Alimentos
- 4.2 Detergentes
- 4.3 Medicinal
- 5 referências
Estrutura química
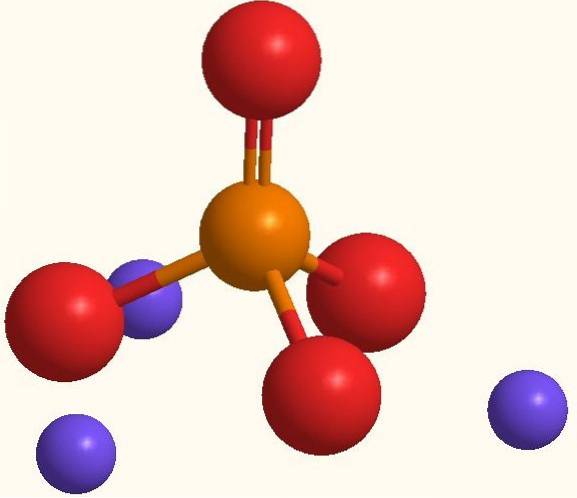
A mesma fórmula Na3PO4 indica que para cada ânion PO43- existem três Na cations+. Esses íons podem ser vistos na imagem acima. Observe que o PO43- tem geometria tetraédrica, com seus átomos de oxigênio carregando uma carga ressonante negativa, que atrai o Na+ do ambiente.
Da mesma forma, a fórmula Na3PO4 ressalta que é o sal anidro, portanto, não há moléculas de água incluídas em seus cristais. As atrações eletrostáticas entre Na+ e o PO43- eles acabam definindo um cristal branco trigonal. Sua ligação iônica é tal que o Na3PO4 tem um ponto de fusão de 1583 ºC, consideravelmente superior ao de vários sais.
Tanto o Na+ como o PO43- São íons que podem ser altamente hidratados, sem afetar negativamente a estabilidade dos cristais.
É por essa razão que os hidratos também podem se cristalizar; entretanto, seus pontos de fusão são inferiores aos do sal anidro, uma vez que as ligações intermoleculares de hidrogênio na água separam os íons e enfraquecem suas interações. No Na3PO412hdoisOu, por exemplo, seu ponto de fusão é 73,4 ºC, muito inferior ao do Na3PO4.
Propriedades
Aparência física
Pode aparecer como cristais brancos definidos ou como um pó ou grânulos da mesma cor. Todas as quantidades físicas expressas abaixo referem-se apenas ao sal anidro Na3PO4.
Ponto de fusão
1583 ºC
Ponto de ebulição
100 ºC
Solubilidade em água
14,5 g / 100 mL a 25 ºC, por isso é considerado um fosfato bastante solúvel em água. No entanto, é insolúvel em solventes orgânicos, como etanol e dissulfeto de carbono..
Densidade
2,536 g / cm3 a 17,5 ºC.
Estabilidade
É um sólido higroscópico. Portanto, deve ser armazenado de forma que não possa ser exposto à umidade.
pH
É um sal fortemente alcalino. Por exemplo, uma solução aquosa 0,1% do mesmo já tem pH 11,5. Esta propriedade serve para ser usada como aditivo em detergentes.
Síntese
Como o fosfato de sódio é produzido ou sintetizado? Para fazer isso, partimos do ácido fosfórico, H3PO4, ou do sal de fosfato diácido de sódio, NaHdoisPO4.
Na grande maioria das sínteses, H é o preferido3PO4. Assim, o H é reagido3PO4 com uma base que neutraliza seus três grupos OH, levando em consideração que este ácido também pode ser escrito como PO (OH)3.
A base de preferência é o hidróxido de sódio, NaOH (na Alemanha), mas também é viável (e mais barato) usar carbonato de sódio ou carbonato de sódio, NadoisCO3 (nos Estados Unidos). As equações para ambas as reações de neutralização são:
N / DdoisCO3 + H3PO4 → NadoisHPO4 + COdois + HdoisOU
N / DdoisHPO4 + NaOH → Na3PO4 + HdoisOU
Observe que ao usar NadoisCO3 Na não é obtido3PO4 mas o NadoisHPO4, que necessitará de uma neutralização subsequente. Como o meio de reação é aquoso, o Na cristaliza3PO412hdoisOu, então, deve ser calcinado para remover seu teor de água e, assim, originar o sal anidro.
Então uma3PO412hdoisOu é caracterizado por "fundir" seus cristais em uma massa compacta que é difícil de quebrar. Quanto menor o tamanho de seus cristais, mais rápida será sua calcinação.
Formulários
Comida

Nos usos de fosfato de sódio é inevitável misturar o Na3PO4 ou para Na3PO412hdoisOu, já que este é o hidrato mais comercializado. Por exemplo, qualquer um dos dois contribui com íons inofensivos (em teoria) para os alimentos aos quais são adicionados, enriquecendo-os com fosfatos e aumentando sua salinidade ao mesmo tempo..
No sal das carnes, o Na3PO412hdoisOu incluído para mantê-los frescos por mais tempo durante o armazenamento. Da mesma forma, é adicionado como um agente emulsificante para que a mistura óleo-água não "corte", mas permaneça unida; e como regulador de pH, pois ajuda a reduzir a acidez dos alimentos (incluindo cereais).
Além disso, é utilizado para engrossar alguns molhos de tomate e para assar bolos ou pães (imagem superior). Este último é devido ao Na3PO412hdoisOu tende a liberar vapor d'água, o que aumenta o tamanho dos poros e o volume da massa da farinha..
Detergentes
O fosfato de sódio é básico o suficiente para saponificar algumas gorduras ou óleos com os quais entra em contato. Sua alcalinidade é então utilizada para melhorar a ação dos detergentes, desde que a superfície a ser desengordurada não seja metálica, pois podem deteriorá-la..
Porém, a produção de detergentes enriquecidos com fosfatos tem sido reduzida devido à eutrofização de lagos e rios e, com ela, a proliferação de algas que cobrem suas superfícies..
Também tem sido usado para fazer um desinfetante: Na3PO41 / 4NaOCl11HdoisOu, que é preparado usando hipoclorito de sódio, NaOCl, em vez de NaOH ou NadoisCO3 para neutralizar o H3PO4.
Medicinal
Então uma3PO4 induz a defecação agindo como um laxante hiperosmótico, necessário para limpar o cólon antes que o paciente seja submetido a uma colonoscopia. Por outro lado, também tem sido usado (adicionado) em suplementos energéticos.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Fosfato trissódico. Banco de dados PubChem. CID = 24243. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Fosfato trissódico. Recuperado de: en.wikipedia.org
- Curran M.P. & Plosker G.L. (2004). Solução oral de fosfato de sódio: uma revisão de seu uso como limpador colorretal. DOI: 10.2165 / 00003495-200464150-00009
- Corey Whelan. (22 de dezembro de 2017). Fosfato de sódio. Recuperado de: healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Processo de produção de fosfato trissódico. Recuperado de: freepatentsonline.com
- MaryAnn Marks. (2018). Por que o fosfato trissódico (TSP) é adicionado aos nossos alimentos? Recuperado de: theingredientguru.com


Ainda sem comentários