
Modelo de gás ideal, comportamento, exemplos
UMA gás ideal ou gás perfeito É aquele em que a força de atração ou repulsão molecular entre as partículas que o compõem é considerada insignificante, portanto, toda a sua energia interna é cinética, ou seja, energia associada ao movimento..
Nesse tipo de gás, as partículas geralmente estão bem distantes umas das outras, embora de vez em quando colidam umas com as outras e com as paredes do recipiente..
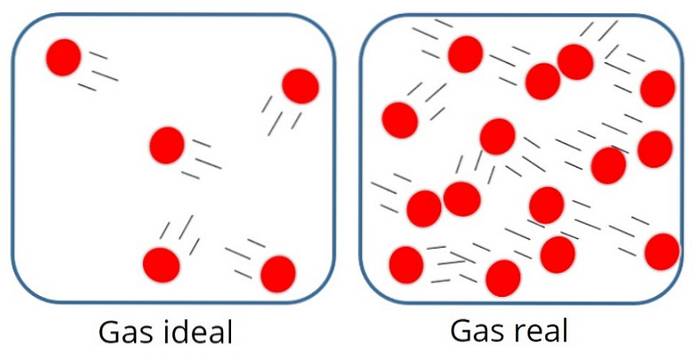
Por outro lado, no gás ideal, nem o tamanho nem a massa das partículas importam, uma vez que se assume que o volume ocupado por elas é muito pequeno em relação ao volume do próprio gás..
Isso, é claro, é apenas uma aproximação, porque na realidade sempre há algum grau de interação entre átomos e moléculas. Também sabemos que as partículas ocupam espaço e têm massa..
No entanto, essas suposições funcionam muito bem em muitos casos, como gases de baixo peso molecular, em uma boa faixa de pressões e temperaturas..
Porém, gases com alto peso molecular, principalmente em altas pressões ou baixas temperaturas, não se comportam de forma alguma como gases ideais e são necessários outros modelos criados com o objetivo de descrevê-los com maior precisão..
Índice do artigo
- 1 primeiros experimentos
- 1.1 As leis dos gases ideais
- 2 Modelo de gás ideal
- 2.1 Equação de estado do gás ideal
- 2.2 A constante do gás
- 3 Comportamento de um gás ideal
- 4 Exemplos de gases ideais
- 4.1 Gases nobres
- 4.2 O balão de ar quente
- 4.3 Balões de hélio
- 5 referências
Primeiros experimentos
As leis que regem os gases são empíricas, ou seja, surgiram da experimentação. Os experimentos mais notáveis foram realizados ao longo dos séculos XVII, XVIII e início do século XIX.
Em primeiro lugar estão os de Robert Boyle (1627-1691) e Edme Mariotte (1620-1684), que modificou independentemente o Pressão em um gás e registrou sua mudança de volume, descobrindo que eles eram inversamente proporcionais: quanto maior a pressão, menor o volume.

Por sua vez, Jacques Charles (1746-1823) estabeleceu que o volume e temperatura os valores absolutos eram diretamente proporcionais, desde que a pressão permanecesse constante.
Amadeo Avogadro (1776-1856) descobriu que dois volumes idênticos de gases diferentes continham o mesmo número de partículas, desde que a pressão e a temperatura fossem as mesmas. E, por fim, Joseph de Gay Lussac (1778-1850), afirmava que, mantendo o volume fixo, a pressão em um gás é diretamente proporcional à temperatura..
As leis dos gases ideais
Essas descobertas são expressas em fórmulas simples, chamando p pressionar, V para o volume, n para o número de partículas e T a temperatura ideal do gás:
Lei de Boyle-Mariotte
Desde que a temperatura seja fixa, ocorre o seguinte:
p⋅V = constante
Charles Law
Quando o gás está sob pressão constante:
V / T = constante
Lei de Gay Lussac
Mantendo o gás em um volume fixo, verifica-se que:
p / T = constante
Lei de Avogadro
Volumes idênticos de gás, sob as mesmas condições de pressão e temperatura, têm o mesmo número de partículas. Portanto, podemos escrever:
V ∝ n
Onde n é o número de partículas e ∝ é o símbolo da proporcionalidade.
Modelo de gás ideal
O modelo de gás ideal descreve um gás tal que:
-Quando as partículas interagem, o fazem por um tempo muito curto, por meio de colisões elásticas, nas quais o momento e a energia cinética são conservados..
-Suas partículas constituintes são pontuais, ou seja, seu diâmetro é muito menor do que a distância média que percorrem entre uma colisão e outra..
-As forças intermoleculares são inexistentes.
-A energia cinética é proporcional à temperatura.
Gases monoatómicos -cuyos átomos no están ligados entre sí- y de bajo peso molecular, en condiciones estándar de presión y temperatura (presión atmosférica y 0 º C de temperatura), tienen un comportamiento tal que el modelo de gas ideal es una muy buena descripción para eles.
Equação de estado do gás ideal
As leis dos gases listadas acima se combinam para formar a equação geral que rege o comportamento do gás ideal:
V ∝ n
V ∝ T
Portanto:
V ∝ n⋅T
Além disso, da lei de Boyle:
V = constante / p
Portanto, podemos afirmar que:
V = (constante x n⋅T) / p
A constante é chamada de constante de gás e é denotado pela letra R. Com essa escolha, a equação de estado do gás ideal relaciona quatro variáveis que descrevem o estado do gás, a saber n, R, p e T, deixando:
p⋅V = n⋅R⋅T
Esta equação relativamente simples é consistente com as leis dos gases ideais. Por exemplo, se a temperatura for constante, a equação se reduz à lei de Boyle-Mariotte.
A constante de gás
Como já dissemos, em condições padrão de temperatura e pressão, ou seja, a 0ºC (273,15 K) e 1 atmosfera de pressão, o comportamento de muitos gases é próximo ao do gás ideal. Nessas condições, o volume de 1 mol do gás é de 22.414 L.
Em tal caso:
R = (p⋅V) / (n⋅T) = (1 atm x 22,414 L) / (1 mol x 273,15 K) = 0,0821 atm ⋅ L / mol ⋅ K
A constante do gás também pode ser expressa em outras unidades, por exemplo, no Sistema Internacional SI vale:
R = 8,314 J⋅ mol-1⋅ K-1
Ao resolver um problema usando a lei dos gases ideais, é conveniente prestar atenção às unidades em que a constante é expressa, pois, como podemos ver, são muitas as possibilidades..
Comportamento de um gás ideal
Como já dissemos, qualquer gás em condições padrão de pressão e temperatura e que seja de baixo peso molecular, comporta-se muito próximo do gás ideal. Portanto, a equação p⋅V = n⋅R⋅T é aplicável para encontrar a relação entre as quatro variáveis que a descrevem: n, p, V e T.
Desta forma, podemos imaginar uma porção de gás ideal encerrada em um recipiente e formada por minúsculas partículas, que de vez em quando colidem entre si e com as paredes do recipiente, sempre elasticamente..
É o que vemos na seguinte animação de uma porção de hélio, um gás nobre monoatômico:
Exemplos de gases ideais
Um gás ideal é um gás hipotético, ou seja, é uma idealização, porém, na prática muitos gases se comportam de maneira muito próxima, possibilitando que o modelo p⋅V = n⋅R arroT dê resultados muito bons..
gases nobres
Exemplos de gases que se comportam como ideais em condições padrão são gases nobres, bem como gases leves: hidrogênio, oxigênio e nitrogênio..
O balão aerostático

A lei de Charles pode ser aplicada ao balão de ar quente na figura 1: o gás aquece, portanto o ar que enche o balão se expande e como consequência ele sobe.
Balões de hélio
O hélio é, junto com o hidrogênio, o elemento mais comum no universo e, ainda assim, é raro na Terra. Por ser um gás nobre, é inerte, ao contrário do hidrogênio, por isso os balões cheios de hélio são amplamente utilizados como elementos decorativos..
Referências
- Atkins, P. 1999. Physical Chemistry. Edições Omega.
- Chang, R. 2013. Chemistry. 11º. Edição. Educação Mc Graw Hill.
- Cengel, Y. 2012. Thermodynamics. 7ª Edição. Colina Mcgraw.
- Cimbala, C. 2006. Mecânica dos Fluidos, Fundamentos e Aplicações. Mc. Colina Graw.
- Giambattista, A. 2010. Física. 2ª Ed. McGraw Hill.



Ainda sem comentários