
Estrutura de glicoproteínas, funções, classes e exemplos
As glicoproteínas ou glicoproteínas são proteínas transmembrana que fazem parte da grande família dos glicoconjugados de membrana e estão presentes em animais, plantas e microrganismos como bactérias, leveduras e arquéias.
Eles foram definidos pela primeira vez em 1908 pelo Comitê de Nomenclatura de Proteínas da Sociedade Americana de Bioquímicos e são o resultado da união glicosídica de uma proteína com uma porção de carboidrato chamada glucana.
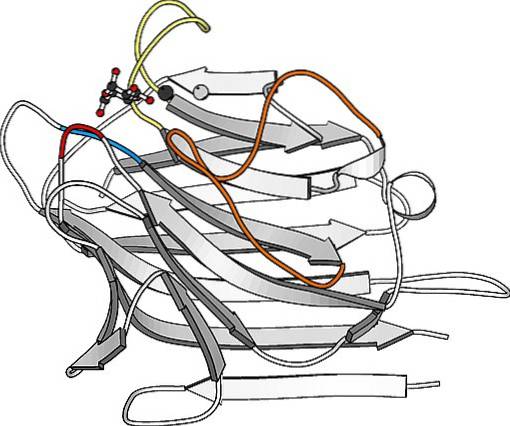
São proteínas particularmente abundantes na superfície da membrana plasmática de muitas células e constituem uma parte importante da camada de carboidratos que as recobre e que em muitos casos é chamada de glicocálice..
As proteínas precursoras das glicoproteínas são covalentemente modificadas no retículo endoplasmático e no complexo de Golgi de muitos eucariotos após sua tradução, embora também haja casos de glicosilação no citosol, mas são menos comuns e ocorrem com apenas um tipo de açúcar.
A glicosilação de proteínas frequentemente tem importantes efeitos funcionais sobre sua atividade, uma vez que pode participar do dobramento e, portanto, do estabelecimento de sua estrutura terciária..
Os glicanos têm múltiplas funções biologicamente importantes para a célula, pois podem conferir especificidade às células e participar de processos de sinalização intracelular e intercelular, por serem ligantes de receptores endógenos e exógenos..
As glicoproteínas, assim como o restante dos glicoconjugados, são tão importantes que uma célula dedica até 1% de seu genoma ao maquinário de glicosilação e, em humanos, mais de 70% das proteínas são modificadas pela glicosilação.
Índice do artigo
- 1 Estrutura
- 2 funções
- 2.1 Estrutural
- 2.2 Reconhecimento de células
- 2.3 Adesão celular
- 2.4 Glicoproteínas como alvos terapêuticos
- 3 aulas
- 4 exemplos
- 5 referências
Estrutura
A estrutura das glicoproteínas é estudada com base em sua sequência de aminoácidos, os locais de glicosilação dentro da sequência e as estruturas das porções de glicano que se ligam a esses locais..
As cadeias de oligossacarídeos que estão ligadas por glicosilação a essas proteínas são geralmente muito diversas, mas são curtas, uma vez que não excedem 15 resíduos de açúcar. Algumas proteínas têm uma única cadeia de oligossacarídeo, mas outras podem ter mais de uma e estas podem ser ramificadas.
A união entre oligossacarídeos e proteínas ocorre por meio do carbono anomérico do carboidrato e do grupo hidroxila (-OH) de um resíduo de serina ou treonina, no caso de OU-glicosilação, ou através do nitrogênio da amida de um resíduo de asparagina, no caso de N-glicosilação.
Os carboidratos assim ligados podem representar até 70% do peso molecular de uma glicoproteína e as características da porção do carboidrato (tamanho e carga, por exemplo) podem proteger algumas proteínas contra a proteólise enzimática..
A mesma proteína pode ter, em diferentes tecidos, diferentes padrões de glicosilação que a tornam uma glicoproteína distinta, pois a estrutura completa inclui não apenas os resíduos de aminoácidos e seus arranjos espaciais, mas também os oligossacarídeos a eles fixados..
Entre os resíduos de açúcar que são repetidamente encontrados nas glicoproteínas estão: D-galactose, D-manose, D-glicose, L-fucose, D-xilose, L-arabinofuranose, N-acetil-D-glucosamina, N-acetil-D- galactosamina, alguns ácidos siálicos e modificações de todos estes.
Características
Estrutural
Do ponto de vista estrutural, as glicoproteínas fornecem cadeias de carboidratos que participam da proteção e lubrificação das células, pois são capazes de se hidratar e formar uma substância viscosa que resiste às agressões mecânicas e químicas..
Algumas glicoproteínas também são encontradas em bactérias e arquéias e são componentes importantes da camada S, que é a camada mais externa da cobertura celular..
Além disso, eles também são encontrados como constituintes de proteínas flagelinas, que fazem parte dos filamentos flagelares usados como órgãos locomotores..
As plantas também possuem glicoproteínas estruturais que são caracterizadas por padrões de glicosilação complexos e que podem ser encontradas como parte da estrutura da parede celular ou na matriz extracelular..
Reconhecimento de células
As glicoproteínas têm funções importantes como locais de reconhecimento entre as células, uma vez que muitos receptores na superfície celular são capazes de reconhecer sequências específicas de oligossacarídeos..
Um exemplo dos reconhecimentos intercelulares que ocorrem através das cadeias de oligossacarídeos na superfície celular é o caso do reconhecimento entre o óvulo e o esperma, necessário para que o fenômeno da fecundação ocorra em organismos multicelulares com reprodução sexuada..
Os grupos sanguíneos em humanos são determinados pela identidade dos açúcares ligados às glicoproteínas que os especificam. Anticorpos e muitos hormônios também são glicoproteínas e suas funções são essenciais para a sinalização e defesa do corpo.
Adesão celular
As células T do sistema imunológico de mamíferos possuem uma glicoproteína com domínios de adesão conhecida como CD2, que é um componente chave para a estimulação imunológica, uma vez que medeia a ligação entre o linfócito e as células apresentadoras de antígeno por meio de seu receptor, a glicoproteína CD58.
Alguns vírus que possuem funções patogênicas importantes para muitos mamíferos, incluindo humanos, possuem glicoproteínas de superfície que atuam nos processos de adesão da partícula viral às células que parasitam..
É o caso da proteína GP120 do Vírus da Imunodeficiência Adquirida Humana ou HIV, que interage com uma proteína de superfície das células humanas conhecida como GP41 e que colabora com a entrada do vírus na célula..
Da mesma forma, muitas proteínas glicosiladas participam de importantes processos de adesão celular que ocorrem na vida normal das células presentes em muitos tecidos de organismos multicelulares..
Glicoproteínas como alvos terapêuticos
Esses complexos de proteína-carboidrato são os alvos preferidos para muitos patógenos, como parasitas e vírus, e muitas glicoproteínas com padrões de glicosilação aberrantes têm papéis críticos em doenças auto-imunes e cânceres.
Por estes motivos, vários investigadores têm assumido a tarefa de propor estas proteínas como possíveis alvos terapêuticos e de conceber métodos de diagnóstico, terapias de nova geração e até mesmo de vacinas..
Lições
A classificação das glicoproteínas é baseada principalmente na natureza da ligação glicosídica que une as porções de proteína e carboidrato e nas características dos glicanos ligados..
De acordo com os resíduos de açúcar, podem haver glicoproteínas com monossacarídeos, dissacarídeos, oligossacarídeos, polissacarídeos e derivados destes. Alguns autores consideram uma classificação de glicoproteínas em:
- Proteoglicanos, que são uma subclasse dentro do grupo das glicoproteínas que contém, na porção de carboidratos, polissacarídeos compostos principalmente de amino açúcares (glicosaminoglicanos).
- Glicopeptídeos, que são moléculas compostas por carboidratos ligados a oligopeptídeos compostos por aminoácidos em suas conformações L e / ou D.
- Glyco aminoácidos, que são aminoácidos ligados a um sacarídeo por meio de qualquer tipo de ligação covalente.
- Glicosilaminoácidos, que são aminoácidos ligados a uma fração de sacarídeo por meio de ligações O-, N- ou S-glicosídicas.
Na nomenclatura dessas proteínas assim ligadas aos carboidratos, os prefixos O-, N- e S- são usados para especificar por quais ligações os açúcares estão ligados à cadeia polipeptídica..
Exemplos
- A glicoforina A é uma das glicoproteínas mais bem estudadas: é uma proteína integrante da membrana dos eritrócitos (células ou glóbulos vermelhos) e possui 15 cadeias de oligossacarídeos covalentemente ligadas a resíduos de aminoácidos na região N-terminal por meio de ligações OU-glicosídicos e uma cadeia ligada por uma ligação N-glicosídico.
- A maioria das proteínas no sangue são glicoproteínas e este grupo inclui imunoglobulinas e muitos hormônios.
- A lactalbumina, uma proteína presente no leite é glicosilada, assim como muitas proteínas pancreáticas e lisossomais.
- Lectinas são proteínas que se ligam a carboidratos e, portanto, têm múltiplas funções de reconhecimento.
- Devemos também destacar muitos hormônios animais que são glicoproteínas; Dentre eles, podem ser citados a lutropina (LH), a folitropina (FSH) e a tireotropina (TSH), que são sintetizadas na glândula pituitária anterior, e a gonadotrofina coriônica produzida na placenta de humanos, primatas e equinos.
Esses hormônios têm funções reprodutivas, pois o LH estimula a esteroidogênese nos ovários e nas células testiculares de Leydig..
- O colágeno, uma proteína abundante presente principalmente nos tecidos conjuntivos de animais, representa uma enorme família de glicoproteínas composta por mais de 15 tipos de proteínas que, embora tenham muitas características em comum, são bastante diferentes..
Essas proteínas contêm porções "não colagênicas", algumas das quais compostas de carboidratos..
- Extensinas são proteínas vegetais que consistem em uma rede de glicoproteínas insolúveis ricas em resíduos de hidroxiprolina e serina. Eles são encontrados na parede das células vegetais e acredita-se que atuem como uma defesa contra diferentes tipos de estresse e patógenos..
- As plantas também têm proteínas semelhantes às da lectina e um exemplo especial dessas são as lectinas da batata, que aparentemente têm a capacidade de aglutinar células sanguíneas, como os eritrócitos..
- Por fim, mas não menos importante, podem ser denominadas as mucinas, que são glicoproteínas secretadas na mucosa e fazem parte da saliva dos animais, cumprindo funções de lubrificação e sinalização, principalmente.
Referências
- Montreuil, J., Vliegenthart, J., & Schachter, H. (1995). Glicoproteínas. (A. Neuberger & L. Deenen, Eds.). Elsevier.
- Nelson, D. L., & Cox, M. M. (2009). Princípios de Bioquímica de Lehninger. Edições Omega (5ª ed.). https://doi.org/10.1007/s13398-014-0173-7.2
- Struwe, W., & Cosgrave, E. (2011). Proteômica funcional e estrutural das glicoproteínas. (R. Owens & J. Nettleship, Eds.). Londres: Springer.
- Voet, D., & Voet, J. (2006). Bioquímica (3ª ed.). Editorial Médica Panamericana.
- Wittman, V. (2007). Glicopeptídeos e glicoproteínas. Síntese, Estrutura e Aplicação. (V. Balzani, J.-M. Lehn, A. de Meijere, S. Ley, K. Houk, S. Schreiber, J. Thiem, Eds.). Leipzig: Springer Science + Business Media, LLC.


Ainda sem comentários