
Propriedades do hidreto de sódio (NaH), reatividade, perigos, usos

O hidreto de sódio É um composto inorgânico de fórmula NaH. Possui uma ligação iônica entre o sódio e o hidreto. Sua estrutura é ilustrada na figura 1. É representativo de hidretos salinos, o que significa que é um hidreto semelhante ao sal, composto de íons Na + e H-, em contraste com hidretos mais moleculares como borano, metano, amônia e água.
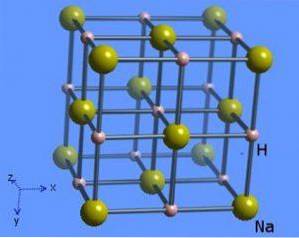
A estrutura cristalina possui um número de coordenação 6, onde cada molécula de sódio é circundada por 8 íons hidreto apresentando uma forma octaédrica e é ilustrada na figura 2 (Mark Winter [The University of Sheffield and WebElements Ltd, 1993-2016).
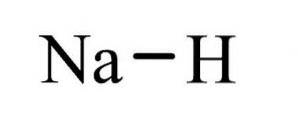
O composto é preparado pela reação direta entre o sódio e o gás hidrogênio (Fórmula de hidreto de sódio - Usos, propriedades, estrutura e fórmula de hidreto de sódio, 2005-2017) da seguinte forma:
H2 + 2Na → 2NaH
O hidreto de sódio é vendido comercialmente como uma forma de dispersão a 60% p / p (porcentagem peso-peso) em óleo mineral para manuseio seguro (SODIUM HYDRIDE, n.d.).
Índice do artigo
- 1 Propriedades físicas e químicas do hidreto de sódio
- 2 Reatividade e perigos
- 3 usos
- 4 referências
Propriedades físicas e químicas do hidreto de sódio
O hidreto de sódio é um sólido branco quando puro, embora geralmente seja cinza ou prateado. Sua aparência é mostrada na figura 3.

O NaH tem um peso molecular de 23,99771 g / mol, uma densidade de 1,396 g / ml e um ponto de fusão de 800 ° C (Royal Society of Chemistry, 2015). É insolúvel em amônia, benzeno, tetracloreto de carbono e dissulfeto de carbono (National Center for Biotechnology Information, n.d.).
O composto é extremamente instável. O NaH puro pode inflamar facilmente no ar. Quando entra em contato com a água presente no ar, libera hidrogênio altamente inflamável.
Quando aberto ao ar e à umidade, o NaH também hidrolisa facilmente na forte base corrosiva de hidróxido de sódio (NaOH) com base na reação:
NaH + H2O → NaOH + H2
Nesta reação, pode-se observar que o hidreto de sódio se comporta como uma base. Isso se deve à eletronegatividade.
O sódio tem eletronegatividade significativamente menor (≈1,0) do que o hidrogênio (≈2,1), o que significa que o hidrogênio atrai a densidade do elétron para si, afastando-se do sódio para gerar um cátion de sódio e um hidreto de ânion.
Para que um composto seja um ácido de Brønsted, ele precisa separar a densidade eletrônica do hidrogênio, ou seja, conectá-lo a um átomo eletronegativo, como oxigênio, flúor, nitrogênio, etc. Só então, pode ser formalmente descrito como H + e pode ser dissociado como tal.
Um hidreto é muito melhor descrito como H- e tem um par de elétrons livres. Como tal, é uma base de Brønsted, não um ácido. Na verdade, se você estender a definição de ácido / base de Brønsted da maneira que Lewis fez, você chegará à conclusão de que o sódio (Na +) é a espécie ácida aqui..
O produto da reação de ácido / base de Brønsted da base H- e ácido H + torna-se H2. Como o hidrogênio ácido é extraído diretamente da água, o gás hidrogênio pode borbulhar, deslocando o equilíbrio mesmo que a reação não seja termodinamicamente favorecida..
Os íons OH- podem permanecer que podem ser escritos com o resto do cátion Na + para dar hidróxido de sódio (por que o hidreto de sódio sólido é uma base e não um ácido quando reagido com água?, 2016).
Reatividade e perigos
O composto é um poderoso agente redutor. Ataca SiO2 em vidro. Inflama em contato com F2, Cl2, Br2 e I2 gasosos (este último em temperaturas acima de 100 ° C), especialmente na presença de umidade, para formar HF, HCl, HBr e HI.
Reage com enxofre para dar Na2S e H2S. Pode reagir explosivamente com dimetilsulfóxido. Reage vigorosamente com acetileno, mesmo a -60 ° C. É espontaneamente inflamável no flúor.
Inicia uma reação de polimerização em etil-2,2,3-trifluoropropionato, de modo que o éster se decompõe violentamente. A presença na reação de succinato de dietila e trifluoroacetato de etila tem causado explosões (SODIUM HYDRIDE, 2016).
O hidreto de sódio é considerado corrosivo para a pele ou olhos, devido ao potencial de subprodutos cáusticos de reações com a água..
Em caso de contato com os olhos, estes devem ser enxaguados com bastante água, sob as pálpebras por pelo menos 15 minutos e consultar imediatamente um médico..
Em caso de contato com a pele, escove imediatamente e enxágue a área afetada com água. Procure atendimento médico se a irritação persistir..
Nocivo se ingerido devido à reação à água. Não induza o vômito. Procure atendimento médico imediato e transfira a vítima para um centro médico..
A dispersão de hidreto de sódio em óleo não é pó. No entanto, o material reagente pode emitir uma névoa cáustica fina. Em caso de inalação, lave a boca com água e leve a vítima para o ar fresco. Procure atendimento médico (Rhom and Hass Inc., 2007).
Formulários
O principal uso do hidreto de sódio é realizar reações de condensação e alquilação que se desenvolvem através da formação de um carbânion (catalisado pela base).
O hidreto de sódio no óleo se assemelha aos alcoolatos de sódio e sódio em sua capacidade de funcionar como agente desprotonante em condensações de éster acetoacético, Claisen, Stobbe, Dieckmann e outras reações relacionadas. Tem vantagens marcantes sobre outros agentes de condensação em que:
- É uma base mais forte, o que resulta em uma desprotonação mais direta.
- Nenhum excesso é necessário.
- O H2 produzido dá uma medida da extensão da reação.
- Reações colaterais, como reduções, são eliminadas.
As alquilações de aminas aromáticas e heterocíclicas, tais como 2-aminopiridina e fenotiazina, são facilmente realizadas com alto rendimento usando misturas de tolueno-metilformamida. A concentração de dimetilformamida é uma variável usada para controlar a taxa de reação (HINCKLEY, 1957).
O uso de hidreto de sódio foi proposto para o armazenamento de hidrogênio para uso em veículos de células de combustível, o hidreto sendo encerrado em grânulos de plástico que são esmagados na presença de água para liberar o hidrogênio..
Referências
- HINCKLEY, M. D. (1957). Fabricação, Manuseio e Usos de Hidreto de Sódio. Advances in Chemistry, Vol. 19, 106-117.
- Mark Winter [Universidade de Sheffield e WebElements Ltd, U. (1993-2016). Sódio: hidreto de sódio. Obtido em WebElements: webelements.com.
- Centro Nacional de Informações sobre Biotecnologia. (s.f.). PubChem Compound Database; CID = 24758. Obtido em PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom and Hass inc. (Dezembro de 2007). Hidreto de Sódio 60% Dispersão em Óleo. Obtido em dow.com.
- Royal Society of Chemistry. (2015). Hidreto de sódio. Obtido em ChemSpider: chemspider.com.
- SODIUM HYDRIDE. (2016). Obtido em cameochemicals: cameochemicals.noaa.gov.
- Fórmula do hidreto de sódio - Usos, propriedades, estrutura e fórmula do hidreto de sódio. (2005-2017). Obtido em Softschools.com: softschools.com.
- SODIUM HYDRIDE. (s.f.). Obtido em chemicalland21: chemicalland21.com.
- Por que o hidreto de sódio sólido é uma base e não um ácido quando reage com a água? (20 de abril de 2016). Obtido em stackexchange: chemical.stackexchange.com.


Ainda sem comentários