
Estrutura, propriedades e usos do hidróxido de berílio (Be (OH) 2)

O hidróxido de berílio É um composto químico formado por duas moléculas de hidróxido (OH) e uma molécula de berílio (Be). Sua fórmula química é Be (OH)dois e é caracterizada por ser uma espécie anfotérica. Em geral, pode ser obtido a partir da reação entre o monóxido de berílio e a água, conforme a seguinte reação química: BeO + HdoisO → Be (OH)dois
Por outro lado, esta substância anfotérica possui uma configuração molecular linear. No entanto, várias estruturas podem ser obtidas a partir do hidróxido de berílio: forma alfa e beta, como mineral e na fase de vapor, dependendo do método utilizado..
Índice do artigo
- 1 Estrutura química
- 1.1 Hidróxido de alfa-berílio
- 1.2 Beta hidróxido de berílio
- 1.3 Hidróxido de berílio em minerais
- 1.4 Vapor de hidróxido de berílio
- 2 propriedades
- 2.1 Aparência
- 2.2 Propriedades termoquímicas
- 2.3 Solubilidade
- 2.4 Riscos de exposição
- 3 usos
- 4 Obtendo
- 4.1 Obtenção de berílio metálico
- 5 referências
Estrutura química
Este composto químico pode ser encontrado em quatro formas diferentes:
Hidróxido alfa-berílio
Adicionar qualquer reagente básico como hidróxido de sódio (NaOH) a uma solução de sal de berílio dá a forma alfa (α) do hidróxido de berílio. Um exemplo é mostrado abaixo:
2 NaOH (diluído) + BeCldois → Be (OH)dois↓ + 2NaCl
2 NaOH (diluído) + BeSO4 → Be (OH)dois↓ + NadoisSW4
Hidróxido de beta berílio
A degeneração desse produto alfa forma uma estrutura cristalina tetragonal metaestável, que após um período prolongado de tempo se transforma em uma estrutura rômbica chamada hidróxido de beta (β) berílio..
Esta forma beta também é obtida como um precipitado de uma solução de sódio-berílio por hidrólise em condições próximas do ponto de fusão..
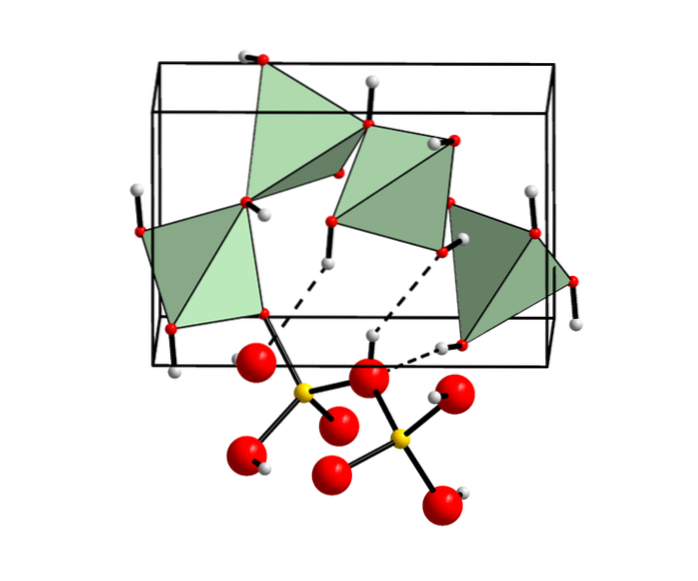
Hidróxido de berílio em minerais
Embora não seja comum, o hidróxido de berílio é encontrado como um mineral cristalino conhecido como behoíta (assim denominado em referência à sua composição química).
Ocorre em pegmatitos graníticos formados pela alteração da Gadolinita (minerais do grupo dos silicatos) em fumarolas vulcânicas..
Este mineral relativamente novo foi descoberto pela primeira vez em 1964 e, atualmente, eles só foram encontrados em pegmatitos de granito localizados nos estados do Texas e Utah, nos Estados Unidos..
Vapor de hidróxido de berílio
Em temperaturas acima de 1200 ° C (2190 ° C), o hidróxido de berílio existe na fase de vapor. É obtido a partir da reação entre o vapor de água e o óxido de berílio (BeO).
Da mesma forma, o vapor resultante tem uma pressão parcial de 73 Pa, medida a uma temperatura de 1500 ° C..
Propriedades
O hidróxido de berílio tem uma massa molar ou peso molecular aproximado de 43,0268 g / mol e uma densidade de 1,92 g / cm3. Seu ponto de fusão é a uma temperatura de 1000 ° C, quando inicia sua decomposição.
Como um mineral, Be (OH)dois (behoite) tem uma dureza de 4 e sua densidade varia entre 1,91 g / cm3 e 1,93 g / cm3.
Aparência
O hidróxido de berílio é um sólido branco, que em sua forma alfa apresenta uma aparência gelatinosa e amorfa. Por outro lado, a forma beta deste composto é constituída por uma estrutura cristalina bem definida, ortorrômbica e estável..
Pode-se dizer que a morfologia do mineral Be (OH)dois é variado, pois pode ser encontrado na forma de cristais reticulares, arborescentes ou agregados esféricos. Da mesma forma, apresenta-se nas cores branco, rosa, azulado e até incolor e com brilho vítreo gorduroso..
Propriedades termoquímicas
Entalpia de formação: -902,5 kJ / mol
Energia de Gibbs: -815,0 kJ / mol
Entropia de formação: 45,5 J / mol
Capacidade de calor: 62,1 J / mol
Capacidade de calor específico: 1.443 J / K
Entalpia padrão de formação: -20,98 kJ / g
Solubilidade
O hidróxido de berílio tem caráter anfotérico, portanto, é capaz de doar ou aceitar prótons e se dissolve em meio ácido e básico em uma reação ácido-base, produzindo sal e água..
Nesse sentido, a solubilidade de Be (OH)dois em água é limitada pelo produto de solubilidade Kps(H2O), que é igual a 6,92 × 10-22.
Riscos de exposição
O limite de exposição humana permitido legal (PEL ou OSHA) de uma substância de hidróxido de berílio definido para uma concentração máxima entre 0,002 mg / m3 e 0,005 mg / m3 é de 8 horas, e para uma concentração de 0,0225 mg / m3 um tempo máximo de 30 minutos.
Essas limitações se devem ao fato de o berílio ser classificado como um carcinógeno do tipo A1 (carcinógeno humano, com base na quantidade de evidências de estudos epidemiológicos).
Formulários
O uso de hidróxido de berílio como matéria-prima para o processamento de alguns produtos é muito limitado (e incomum). Porém, é um composto utilizado como principal reagente para a síntese de outros compostos e obtenção de berílio metálico..
Obtendo
O óxido de berílio (BeO) é o composto químico de berílio de alta pureza mais amplamente usado na indústria. É caracterizado como um sólido incolor com propriedades de isolamento elétrico e alta condutividade térmica.
Nesse sentido, o processo para sua síntese (em qualidade técnica) na indústria primária é realizado da seguinte forma:
- O hidróxido de berílio se dissolve em ácido sulfúrico (HdoisSW4).
- Uma vez realizada a reação, a solução é filtrada, para que assim sejam eliminadas as impurezas insolúveis de óxido ou sulfato..
- O filtrado é submetido à evaporação para concentrar o produto, que é resfriado para obtenção de cristais de sulfato de berílio BeSO4.
- O beijo4 calcina a uma temperatura específica entre 1100 ° C e 1400 ° C.
O produto final (BeO) é utilizado na fabricação de peças cerâmicas especiais para uso industrial..
Obtenção de berílio metálico
Durante a extração e processamento de minerais de berílio, impurezas são geradas, como óxido de berílio e hidróxido de berílio. Este último é submetido a uma série de transformações até a obtenção do berílio metálico..
Be (OH) é reagidodois com uma solução de bifluoreto de amônio:
Be (OH)dois + 2 (NH4) HFdois → (NH4)doisBeF4 + 2 hdoisOU
O (NH4)doisBeF4 está sujeito a um aumento de temperatura, passando por decomposição térmica:
(NH4)doisBeF4 → 2NH3 + 2HF + BeFdois
Finalmente, a redução do fluoreto de berílio a uma temperatura de 1300 ° C com magnésio (Mg) resulta em berílio metálico:
BeFdois + Mg → Be + MgFdois
O berílio é utilizado em ligas metálicas, produção de componentes eletrônicos, fabricação de telas e janelas de radiação utilizadas em máquinas de raio-X..
Referências
- Wikipedia. (s.f.). Hidróxido de berílio. Recuperado de en.wikipedia.org
- Holleman, A. F.; Wiberg, E. e Wiberg, N. (2001). Hidróxido de berílio. Obtido em books.google.co.ve
- Publishing, M. D. (s.f.). Behoite. Recuperado de handbookofmineralogy.org
- Todas as reações. (s.f.). Hidróxido de berílio Be (OH)dois. Obtido em allreactions.com
- PubChem. (s.f.). Hidróxido de berílio. Recuperado de pubchem.ncbi.nlm.nih.gov
- Walsh, K. A. e Vidal, E. E. (2009). Química e processamento de berílio. Obtido em books.google.co.ve


Ainda sem comentários