
Estrutura, propriedades, usos, riscos do hidróxido de níquel (III)

O hidróxido de níquel (III) É um composto inorgânico onde o níquel metálico tem um número de oxidação de 3+. Sua fórmula química é Ni (OH)3. Segundo fontes consultadas, até o momento não foi possível verificar a existência de hidróxido de níquel (III) Ni (OH)3, mas foi possível obter oxo-hidróxido de níquel (III), NiO (OH).
Oxohidróxido de níquel (III) NiO (OH) é um sólido cristalino preto que cristaliza em duas formas: as formas beta e gama. A forma cristalina mais comum de NiO (OH) é beta.
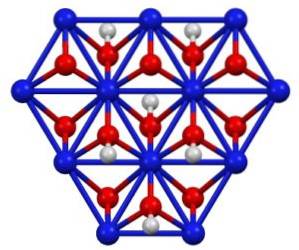
NiO (OH) pode ser obtido pela oxidação de soluções de nitrato de níquel (II) (Ni (NO3)dois) com cloro (Cldois) ou bromo (Brdois) na presença de hidróxido de potássio (KOH). O oxo-hidróxido de níquel (III) é muito solúvel em ácidos. Tem aplicação em baterias de níquel, em supercapacitores e como catalisador regenerável.
Oxo-hidróxido de níquel (III) NiO (OH) e hidróxido de níquel (II) Ni (OH)dois estão unidos na operação da maioria de suas aplicações, uma vez que ambas fazem parte da mesma equação óxido-redução..
Por ser um composto de níquel, o NiO (OH) apresenta os mesmos riscos de outros sais de níquel, ou seja, irritação cutânea ou dermatite e câncer.
Índice do artigo
- 1 estrutura de cristal
- 2 configuração eletrônica
- 3 Nomenclatura
- 4 propriedades
- 4.1 Estado físico
- 4.2 Solubilidade
- 4.3 Outras propriedades
- 5 usos
- 5.1 Em baterias de níquel
- 5.2 Em eletrocatálise como um catalisador regenerável
- 5.3 Em supercapacitores
- 5.4 Na oxidação de íons metálicos
- 6 riscos
- 7 referências
Estrutura de cristal
O oxo-hidróxido de níquel (III) cristaliza em duas formas: beta e gama. A forma beta β-NiO (OH) tem uma estrutura muito semelhante a β-Ni (OH)dois, o que parece lógico, uma vez que o primeiro vem da oxidação do último.
A forma gama γ-NiO (OH) é o produto da oxidação do hidróxido de níquel (II) em sua forma alfa, α-Ni (OH)dois. Como o último, gama tem uma estrutura em camadas com íons de metais alcalinos, ânions e água intercalados entre as camadas..
Configuração eletronica
No NiO (OH), o níquel está no estado de oxidação 3+, o que significa que suas camadas mais externas estão sem 3 elétrons, ou seja, faltam dois elétrons na camada 4s e um elétron da camada 3d. A configuração eletrônica do Ni3+ em NiO (OH) é: [Ar] 3d7, onde [Ar] é a configuração eletrônica do gás nobre argônio.
Nomenclatura
- NiO (OH): Oxohidróxido de níquel (III)
- Níquel preto
Propriedades
Estado físico
Sólido cristalino preto.
Solubilidade
O oxohidróxido de NiO (OH) é muito solúvel em ácidos. A fase gama se dissolve em ácido sulfúrico com evolução de oxigênio.
Outras propriedades
Em água quente torna-se níquel (II) e (III) oxo-hidróxido, Ni3OUdois(OH)4.
Ele se decompõe a 140 ºC em óxido de níquel (II) (NiO), água e oxigênio.
A fase gama (γ-NiO (OH)) pode ser obtida de várias maneiras, por exemplo, tratando o níquel com uma mistura fundida de peróxido de sódio (NadoisOUdois) e hidróxido de sódio (NaOH) a 600 ºC e resfriamento em água gelada.
A fase gama se decompõe ao aquecer a 138 ºC.
Formulários
Em baterias de níquel
A bateria de níquel-ferro de Edison, na qual KOH é usado como eletrólito, é baseada na reação do oxo-hidróxido de níquel (III) com o ferro:
Download:
Fe + 2NiO (OH) + HdoisO ⇔ Fe (OH)dois + 2Ni (OH)dois
Carregar:
É uma reação reversível de oxidação-redução.
Uma série de processos químicos e eletroquímicos ocorrem no ânodo dessas baterias. Aqui está um esboço geral:
Download
β-Ni (OH)dois ⇔ β-NiO (OH) + H+ + e-
Carregar
Envelhecimento ↑ ↓ Sobrecarga
Download
α-Ni (OH)dois ⇔ γ-NiO (OH) + H+ + e-
Carregar
Na tecnologia de bateria de níquel, o oxo-hidróxido de níquel (III) NiO (OH) é chamado de "massa de níquel ativa".

Em eletrocatálise como um catalisador regenerável
O NiO (OH) tem sido utilizado com sucesso na eletrossíntese de azopirazóis, por meio da oxidação eletrocatalítica de aminopirazóis. Sua utilidade na síntese de ácidos carboxílicos a partir de álcoois ou compostos carbonílicos também foi comprovada..

Outro exemplo é a conversão quantitativa de hidroximetilpiridina em um ácido piridinocarboxílico. Neste caso, o eletrodo de aço ou níquel correspondente ao ânodo é coberto com uma camada de NiO (OH). O meio em que a eletrólise é realizada é alcalino.
Nessas reações, o NiO (OH) atua como um mediador de redução-oxidação, ou mediador "redox"..
A eletrólise é realizada em uma célula com ânodo de níquel e cátodo de titânio, em meio alcalino. Ni (OH) é formado durante o processodois na superfície do ânodo de níquel, que é rapidamente oxidado a NiO (OH):
Ni (OH)dois + Oh- - e- ⇔ NiO (OH) + HdoisOU
O NiO (OH) reage com o substrato orgânico e o produto orgânico desejado é obtido, regenerando o Ni (OH)dois:
NiO (OH) + composto orgânico → Ni (OH)dois + produtos
À medida que Ni (OH) regeneradois, a reação de catálise é continuada.
A utilização do NiO (OH) como eletrocatalisador permite a obtenção de compostos orgânicos com baixo custo e de forma ecologicamente correta..
Em supercondensadores
NiO (OH) junto com Ni (OH)dois são excelentes materiais para eletrodos de supercapacitor. supercapacitores).
Ni (OH)dois + Oh- ⇔ NiO (OH) + HdoisO + e-
Possuem alta capacitância, baixo custo e, segundo algumas referências, baixo impacto ambiental.

No entanto, eles têm baixa condutividade. Isso é resolvido com a utilização de nanopartículas dos referidos compostos, uma vez que aumenta a área superficial e diminui a distância necessária para a difusão, o que garante uma alta velocidade de transferência de elétrons e / ou íons..
Na oxidação de íons metálicos
Uma das aplicações comerciais do oxo-hidróxido de níquel (III) é baseada em sua capacidade de oxidar íons cobalto (II) em solução para íons cobalto (III)..
Riscos
O níquel em solução é mais estável como o íon Nidois+, portanto, não é comum entrar em contato com soluções de Ni3+. Porém, os cuidados são os mesmos, pois o níquel, seja metálico, em solução ou na forma de seus sais sólidos, pode causar sensibilização da pele..
É aconselhável o uso de equipamentos e vestimentas de proteção, como protetor facial, luvas e calçados de segurança. Tudo isso deve ser utilizado sempre que houver a possibilidade de entrar em contato com soluções de níquel..
Se ocorrer dermatite, ela deve ser tratada com um médico para descartar que seja causada pelo níquel..
Em relação à possibilidade de inalação, é boa prática manter as concentrações de poeira de sais de níquel no ar muito baixas, por meio de ventilação local, e usar proteção respiratória quando necessário..
Todos os compostos de níquel são classificados pela Agência Internacional de Pesquisa sobre o Câncer, ou IARC. Agência Internacional de Pesquisa sobre o Câncer), na categoria de carcinógenos para humanos.
Isso é baseado em dados epidemiológicos e experimentais.
Referências
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Lyalin, B.V. et al. Eletrossíntese de azopirazóis via oxidação de N-alquilaminopirazóis em um ânodo NiO (OH) em álcali aquoso - Um método verde para o homocoplamento N-N. Letras de tetraedro. 59 (2018) 2741-2744. Recuperado de sciencedirect.com.
- Liuyang, Zhang, et al. (2018). Materiais à base de níquel para supercapacitores. Materiais hoje. Recuperado de sciencedirect.com
- Ettel, V.A. e Mosolu, M. A. (1977). Preparação de Níquel Negro. NÓS. Patente No. 4.006.216. 1 de fevereiro de 1977.
- Scharbert, B. (1993). Processo para oxidar derivados de hidroximetilpiridina em derivados de ácido piridinocarboxílico em ânodos de óxido de níquel e hidróxido NÓS. Patente No. 5.259.933. 9 de novembro de 1993.
- Kirk-Othmer (1994). Enciclopédia de Tecnologia Química. Volume 17. Quarta edição. John Wiley & Sons.
- Enciclopédia de Química Industrial de Ullmann. (1990). Quinta edição. Volume A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Hidróxidos de níquel. Em Handbook of Battery Materials. VCH Publisher. Recuperado de osti.gov.



Ainda sem comentários