
Tipos de incretina e sua estrutura, funções, mecanismo de ação
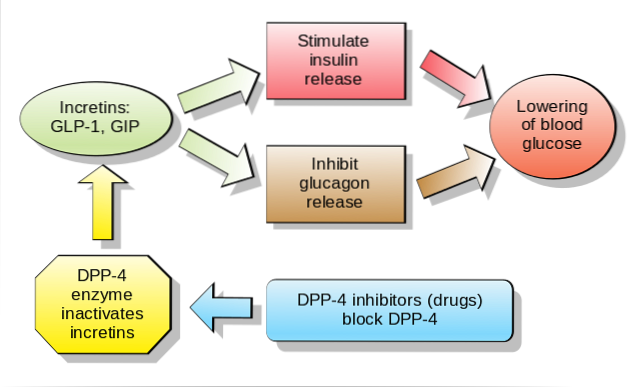
As incretina são hormônios gastrointestinais que estimulam a secreção de concentrações fisiológicas de insulina. O termo é atualmente usado para se referir a dois hormônios intestinais diferentes, que têm nomes técnicos diferentes: GIP ou "polipeptídeo insulinotrópico dependente de glicose" e GLP-1 ou "peptídeo 1 semelhante ao glucagon".
"Incretina" é uma palavra e um conceito cunhado em 1932 pelo fisiologista belga Jean La Barre, que o introduziu para definir os fatores hormonais intestinais que complementavam os efeitos da secretina na secreção pancreática endócrina..
Em outras palavras, La Barre usou o termo incretina para denotar qualquer hormônio intestinal que, em condições fisiológicas, fosse capaz de estimular ou contribuir para a secreção de hormônios pancreáticos, como insulina, glucagon, polipeptídeo pancreático (PP) e somatostatina..
No entanto, atualmente o termo "incretina" é usado apenas para denotar aqueles hormônios capazes de estimular a síntese de insulina pancreática dependente de glicose, especificamente dois peptídeos conhecidos como GIP e GLP-1. No entanto, o advento de novas tecnologias e estudos endocrinológicos mais profundos podem revelar muitos outros peptídeos com atividades semelhantes..
Índice do artigo
- 1 Tipos de incretinas e sua estrutura
- 2 funções
- 3 Mecanismo de ação
- 3.1 GIP: polipeptídeo insulinotrópico dependente de glicose
- 3.2 GLP-1: Peptídeo 1 semelhante ao glucagon
- 4 referências
Tipos de incretinas e sua estrutura
Tradicionalmente, apenas duas incretinas foram definidas em humanos: polipeptídeo insulinotrópico dependente de glicose (GIP) e peptídeo semelhante ao glucagon 1 (GLP-1); os dois hormônios atuam aditivamente na estimulação da secreção de insulina.
O primeiro a ser isolado foi o polipeptídeo insulinotrópico dependente de glicose (GIP). Polipeptídeo Insulinotrópico Dependente de Glicose) É um hormônio peptídico com cerca de 42 aminoácidos e pertence à família de peptídeos glucagon-secretina.

A segunda incretina descoberta foi o peptídeo 1 semelhante ao glucagon (GLP-1). Peptídeo-1 semelhante ao glucagon), que é um subproduto do gene que codifica o hormônio "proglucagon"; parte da extremidade C-terminal da proteína, para ser mais exato.
Características
Inicialmente, as incretinas foram definidas como fatores derivados do trato intestinal que têm a capacidade de reduzir os níveis de glicose plasmática por meio da estimulação da secreção de hormônios pancreáticos, como a insulina e o glucagon..
Esse conceito foi mantido com o advento dos radioimunoensaios, onde a comunicação permanente entre o intestino e o pâncreas endócrino foi confirmada..
A administração oral de glicose mostrou estar associada a aumentos significativos nos níveis plasmáticos de insulina, especialmente em comparação aos resultados obtidos com glicose intravenosa..
Acredita-se que as incretinas sejam responsáveis pela secreção de quase 70% da insulina plasmática após a administração oral de glicose, pois são hormônios secretados em resposta à ingestão de nutrientes, o que aumenta a secreção de glicose-insulina dependente..
Muitos esforços estão sendo feitos atualmente em relação à administração oral ou intravenosa de incretinas a pacientes com doenças como diabetes mellitus tipo 2 ou intolerância oral à glicose. Isso porque estudos têm demonstrado, ainda que preliminarmente, que essas substâncias facilitam a rápida queda dos níveis glicêmicos após a ingestão alimentar..
Mecanismo de ação
GIP: polipeptídeo insulinotrópico dependente de glicose
Esta incretina é produzida pelas células K do intestino delgado (no duodeno e jejuno, especificamente) em resposta à ingestão de gordura ou glicose e é responsável por aumentar a secreção de insulina estimulada por glicose.
A expressão do gene que codifica esse fator hormonal foi demonstrada em humanos e roedores, tanto no estômago quanto no intestino. Estudos realizados com esse hormônio indicam que ele é derivado de um precursor "proGIP" de 153 aminoácidos, que possui dois peptídeos sinal em suas extremidades N e C terminais, que são clivados para produzir um peptídeo ativo de 42 resíduos..
A meia-vida do GIP é inferior a 7 minutos, uma vez que é sintetizado e processado enzimaticamente. Este peptídeo é reconhecido por um receptor específico, o GIPR, que está localizado na membrana plasmática das células do pâncreas, no estômago, no intestino delgado, no tecido adiposo, no córtex adrenal, na glândula pituitária, em o coração, pulmões e outros órgãos importantes.
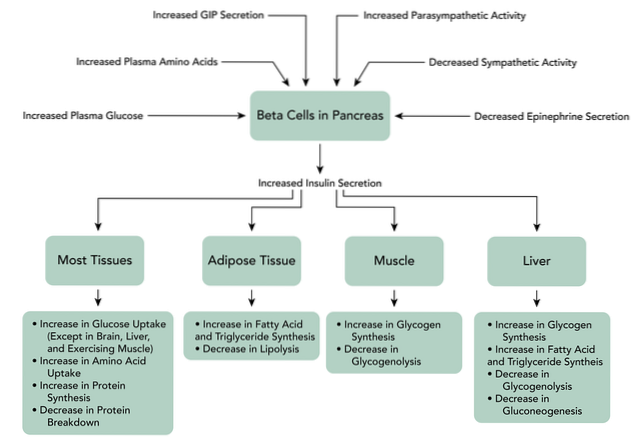
Quando o GIP se liga a seus receptores nas células beta do pâncreas, ele desencadeia um aumento na produção de cAMP, também a inibição dos canais de potássio dependentes de ATP, o aumento do cálcio intracelular e, finalmente, a exocitose dos grânulos de armazenamento de insulina.
Além disso, esse peptídeo pode estimular a transcrição gênica e a biossíntese da insulina, bem como os outros componentes das células beta pancreáticas para "censo" da glicose. Embora o GIP atue principalmente como hormônio incretínico, também exerce outras funções em outros tecidos como sistema nervoso central, ossos, entre outros..
GLP-1: Peptídeo 1 semelhante ao glucagon
Este peptídeo é produzido a partir do gene que codifica para "proglucagon", portanto, é um peptídeo que compartilha cerca de 50% de identidade com a sequência do glucagon e, portanto, é chamado de peptídeo "semelhante ao glucagon".
O GLP-1, um produto proteolítico pós-tradução, é específico do tecido e é produzido pelas células L do intestino em resposta à ingestão de alimentos. Como o GIP, esta incretina tem a capacidade de aumentar a secreção de insulina estimulada por glicose.
Expressão e processamento de genes
Este peptídeo é codificado em um dos exons do gene do proglucagon, que é expresso nas células alfa do pâncreas, nas células L do intestino (no íleo distal) e nos neurônios do tronco encefálico e hipotálamo.
No pâncreas, a expressão desse gene é estimulada pelo jejum e hipoglicemia (baixas concentrações de glicose no sangue), sendo inibida pela insulina. Nas células intestinais, a expressão do gene para proglucagon é ativada por níveis aumentados de cAMP e ingestão de alimentos.
O produto resultante da expressão desse gene é processado pós-translacionalmente nas células enteroendócrinas L (no intestino delgado), resultando não apenas na liberação do peptídeo 1 semelhante ao glucagon, mas também em outros fatores um tanto desconhecidos como a glicentina, oxitomodulina, peptídeo 2 semelhante ao glucagon, etc..
Produção e ação
A ingestão de alimentos, especialmente aqueles ricos em gorduras e carboidratos, estimula a secreção do peptídeo GLP-1 pelas células enteroendócrinas L intestinais (também pode ocorrer estimulação nervosa ou mediada por muitos outros fatores).
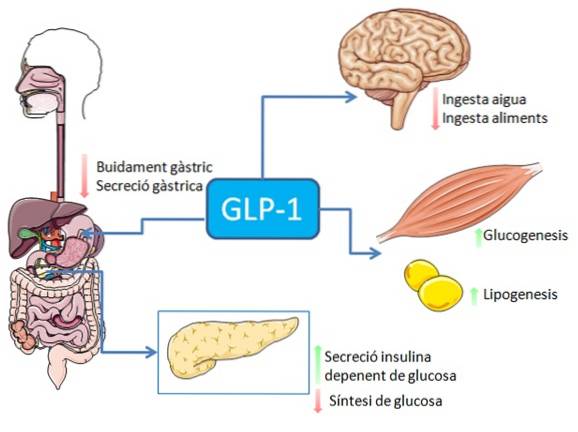
Em humanos e roedores, esse peptídeo é liberado na corrente sanguínea em duas fases: 10-15 minutos após a ingestão e 30-60 minutos depois. A vida ativa desse hormônio no sangue é inferior a 2 minutos, pois é rapidamente inativado proteoliticamente pela enzima dipeptidil peptidase-4 (DPP-4).
O GLP-1 se liga a um receptor de membrana específico (GLP-1R) em várias células do corpo, incluindo algumas das células endócrinas do pâncreas, onde estimula a secreção de insulina dependente de glicose.
Como?
A ligação do GLP-1 ao seu receptor nas células beta do pâncreas ativa a produção de cAMP mediada pela adenilato ciclase nessas células. Há uma inibição direta dos canais de potássio dependentes de ATP, que despolarizam a membrana celular.
Subsequentemente, os níveis de cálcio intracelular aumentam, que é o resultado do influxo de cálcio extracelular dependente de GLP-1 através de canais de cálcio dependentes de voltagem, a ativação de canais de cátions não seletivos e a mobilização de reservas de cálcio..
Também aumenta a síntese mitocondrial de ATP, o que favorece a despolarização. Posteriormente, os canais de potássio dependentes de voltagem são fechados, evitando a repolarização das células beta e, finalmente, ocorre a exocitose dos grânulos de armazenamento de insulina..
No sistema gastrointestinal, a ligação do GLP-1 aos seus receptores tem efeito inibitório na secreção de ácido gástrico e no esvaziamento gástrico, o que atenua o aumento dos níveis de glicose no sangue associados à ingestão de alimentos..
Referências
- Baggio, L. L., & Drucker, D. J. (2007). Biologia das incretinas: GLP-1 e GIP. Gastroenterologia, 132 (6), 2131-2157.
- Deacon, C. F., & Ahrén, B. (2011). Fisiologia das incretinas na saúde e na doença. A revisão dos estudos sobre diabéticos: RDS, 8 (3), 293.
- Grossman, S. (2009). Diferenciando terapias de incretina com base na atividade de estrutura e metabolismo: foco em liraglutida. Farmacoterapia: The Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W., & Egan, J. M. (2008). O papel das incretinas na homeostase da glicose e no tratamento do diabetes. Revisões farmacológicas, 60 (4), 470-512.
- Nauck, M. A., & Meier, J. J. (2018). Hormônios incretina: seu papel na saúde e na doença. Diabetes, Obesidade e Metabolismo, 20, 5-21.
- Rehfeld, J. F. (2018). A origem e compreensão do conceito de incretina. Fronteiras em endocrinologia, 9.
- Vilsbøll, T., & Holst, J. J. (2004). Incretinas, secreção de insulina e diabetes mellitus tipo 2. Diabetologia, 47 (3), 357-366

Ainda sem comentários