
Justificativa, protocolo e aplicações da imunofluorescência
O imunofluorescência é uma técnica de imunocoloração poderosa que usa anticorpos covalentemente ligados a moléculas fluorescentes para identificar alvos específicos em amostras de células fixadas em um suporte sólido.
Essa técnica envolve observação microscópica com especificidade imunológica, possibilitando observar células vivas ou mortas que podem apresentar quantidades minúsculas de antígenos. É amplamente utilizado no campo da pesquisa e no diagnóstico clínico de várias patologias..
Esta técnica, principalmente qualitativa (com algumas variantes quantitativas), tem a ver especificamente com a visualização de uma amostra pelo sinal de produto de um fluoróforo, que é uma molécula fluorescente ligada a um anticorpo e que é capaz de ser excitada em um determinado comprimento de onda ..
No contexto celular, é muito útil estudar a presença / ausência e a localização subcelular de proteínas. A técnica foi usada em seus primeiros dias no ambiente clínico para o diagnóstico de vírus como a gripe e, posteriormente, para muitas outras doenças infecciosas..
É uma técnica altamente sensível e, com o equipamento de microscopia adequado, pode ter uma resolução muito boa. Requer, para sua observação, o uso de microscópios confocais ou de epifluorescência..
Porém, apesar de muito popular, pode apresentar alguns problemas importantes no que diz respeito à obtenção de fluorescência inespecífica que gera algum “ruído” de fundo, o que muitas vezes limita a leitura adequada dos resultados..
Índice do artigo
- 1 justificativa
- 2 protocolo
- 2.1 -Preparação
- 2.2 Fixação de amostras
- 2.3 Permeabilização
- 2.4 Bloqueio
- 2.5 Imunocoloração ou imunocoloração
- 2.6 Montagem e observação
- 3 tipos
- 3.1 Imunofluorescência direta ou primária
- 3.2 Imunofluorescência indireta ou secundária
- 4 aplicativos
- 5 referências
Base
A imunofluorescência é baseada na exploração do fenômeno biológico da reação de interação entre um anticorpo e um antígeno. Tem a ver especificamente com a visualização ou detecção desta reação por moléculas fluorescentes excitantes em um comprimento de onda específico.
Um anticorpo é uma proteína imunoglobulina secretada por células B ativas, que é gerada especificamente contra um antígeno, ao qual pode se ligar com grande afinidade e especificidade. A imunofluorescência utiliza imunoglobulinas IgG, que são solúveis no soro sanguíneo..
Os anticorpos são moléculas de até 950 kDa compostas por duas cadeias peptídicas curtas (leves) e duas longas em forma de "Y" (pesadas). As cadeias leve e pesada são divididas em dois domínios: uma variável, capaz de reconhecer o antígeno, e outra constante ou conservada, característica de cada espécie..
Os antígenos são funcionalmente definidos como moléculas que podem ser reconhecidas por um anticorpo e são principalmente proteínas. Quando um animal é exposto a um antígeno, os linfócitos do sistema imunológico são ativados, produzindo anticorpos específicos contra ele e que funcionam como sistema de defesa.
Um antígeno, como uma proteína, por exemplo, pode ter mais de um epítopo ou local de reconhecimento por um anticorpo, de modo que o soro do animal exposto a um antígeno pode ter anticorpos policlonais contra diferentes regiões da mesma proteína..
A imunofluorescência, então, explora a capacidade de um animal de produzir anticorpos policlonais contra um antígeno específico para purificá-lo e, posteriormente, usá-lo para a detecção do mesmo antígeno em outros contextos..
Entre os corantes ou moléculas fluorescentes mais usados para algumas técnicas de imunofluorescência estão isotiocianato de fluoresceína (FITC), isotiocianato de tetrametilrodamina-5 e 6 (TRITC), muitos cianinos como Cy2, Cy3, Cy5 e Cy7 e corantes chamados Alexa Fluor®, como Alexa Fluor®, como Alexa Fluor® Fluor®448.
Protocolo
O protocolo de imunofluorescência varia dependendo de muitos fatores, no entanto, em termos gerais, ele abrange uma sequência linear de etapas consistindo em:
- Preparação de lâminas e células
- Fixação de amostras
- Permeabilização
- Bloqueando
- Imunocoloração ou imunocoloração
- Montagem e observação
-Preparação
Das amostras
A preparação das amostras dependerá da sua natureza e do tipo de experiência a realizar. A seguir, será explicado o caso mais simples, que envolve o uso de células em suspensão..
As células em suspensão, ou seja, em meio de cultura líquido, devem primeiro ser separadas por centrifugação e depois lavadas com solução tampão ou "amortecedor" isosmótico, preservando sua integridade.
Normalmente, é utilizado um tampão fosfato-salino conhecido como PBS, no qual as células são ressuspensas e essa mistura é centrifugada novamente para obter as células livres do meio de cultura, que podem conter substâncias interferentes..
Das lâminas
As lâminas utilizadas para observação microscópica, onde as células serão posteriormente fixadas para os respectivos tratamentos a jusante, também devem ser cuidadosamente preparadas..
Estes são recobertos ou "sensibilizados" com uma solução de polilisina, um polímero sintético que atuará como uma "cola molecular" entre as células e o suporte sólido, graças à interação eletrostática entre as cargas positivas de seus grupos amino e os células. cargas negativas nas proteínas que revestem as células.
Fixação de amostras
Esse processo consiste em imobilizar as proteínas encontradas no interior da célula para manter intacta sua localização espacial. As moléculas utilizadas devem ser capazes de cruzar todos os tipos de membranas celulares e formar redes com proteínas covalentes..
Formaldeído e paraformaldeído, glutaraldeído e até mesmo metanol são amplamente utilizados, com os quais as amostras de células são incubadas por um certo tempo e depois lavadas com uma solução tampão isosmótica.
Após a fixação das células, elas continuam a ser fixadas às lâminas previamente sensibilizadas com polilisina..
Permeabilização
Dependendo do tipo de teste realizado, será necessário permeabilizar ou não as células em estudo. Se o que se busca é saber a localização, presença ou ausência de determinada proteína na superfície celular, não será necessária a permeabilização..
Por outro lado, se você quiser saber a localização de uma proteína dentro da célula, a permeabilização é fundamental e consistirá na incubação das amostras com Triton X-100, um detergente capaz de permeabilizar as membranas celulares..
Bloqueando
Uma etapa fundamental em todas as técnicas imunológicas é o bloqueio. Nessa etapa do procedimento, o bloqueio consiste em cobrir, nas lâminas sensibilizadas, todos os locais com moléculas de polilisina às quais as células não aderiram. Ou seja, impede qualquer união inespecífica.
Normalmente, para bloqueio, soluções com albumina de soro bovino (BSA) em tampão PBS são utilizadas e os melhores resultados são obtidos quanto maior o tempo de incubação com esta solução. Após cada etapa, incluindo o bloqueio, é necessário lavar o restante da solução..
Imunocoloração ou imunocoloração
A imunocoloração ou procedimento de imunocoloração dependerá principalmente de se tratar de uma imunofluorescência direta ou indireta (ver abaixo)..
Se for imunofluorescência primária ou direta, as amostras serão incubadas com os anticorpos desejados, que deverão ser acoplados aos corantes fluorescentes. O procedimento de incubação consiste em fazer uma diluição do anticorpo em uma solução que também conterá BSA, mas em menor proporção.
Quando o caso for imunofluorescência secundária ou indireta, devem ser realizadas duas incubações consecutivas. Primeiro com os anticorpos desejados e depois com os anticorpos que são capazes de detectar as regiões constantes das imunoglobulinas primárias. São esses anticorpos secundários que se ligam covalentemente aos fluoróforos..
A técnica é muito versátil, permitindo a marcação simultânea de mais de um antígeno por amostra, desde que haja anticorpos primários acoplados a diferentes fluoróforos, no caso da imunofluorescência direta..
Para marcação simultânea em imunofluorescência indireta, é necessário garantir que cada anticorpo primário seja produzido em um animal diferente, bem como que cada anticorpo secundário seja acoplado a um fluoróforo diferente..
Tal como o bloqueio, a incubação com anticorpos dá melhores resultados quanto maior for o tempo de incubação. Após cada etapa é necessário lavar o excesso de anticorpos que não se ligaram às amostras e na imunofluorescência secundária é necessário bloquear antes de adicionar o anticorpo secundário.
Certas técnicas usam outras manchas que não estão relacionadas à imunocoloração, como a coloração do DNA nuclear com o fluoróforo DAPI..
Montagem e observação
Durante o tempo final de incubação com os fluoróforos é necessário que as amostras permaneçam no escuro. Para observação microscópica, é comum o uso de algumas substâncias para preservar a fluorescência dos fluoróforos acoplados aos anticorpos..
Tipos
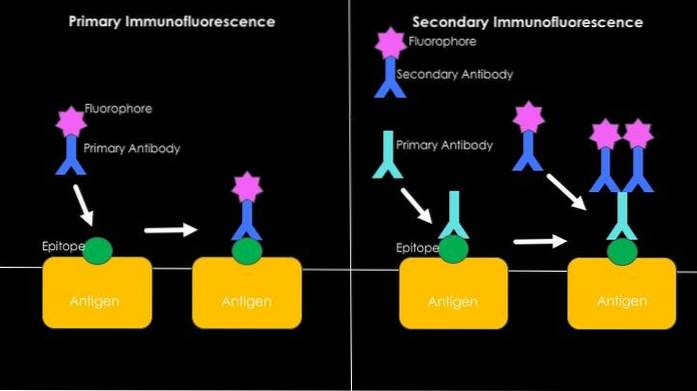
Imunofluorescência direta ou primária
Tem a ver com a detecção de antígenos por meio do uso de anticorpos fluorescentes. A principal vantagem da utilização dessa técnica é a sua rapidez, porém, muitos casos de ligações inespecíficas podem ocorrer no processo, principalmente no estudo de soros humanos, por serem ricos em anticorpos altamente heterogêneos..
Imunofluorescência indireta ou secundária
É também conhecida como técnica do "sanduíche" e envolve o desenvolvimento da técnica em duas etapas. A primeira diz respeito ao uso de um anticorpo não fluorescente e sua ligação ao antígeno de interesse..
Contra a região constante deste primeiro anticorpo (que agora servirá como antígeno) é utilizado um segundo anticorpo capaz de reconhecê-lo, o qual está associado a uma molécula fluorescente.
O aparecimento de um sinal fluorescente será o resultado do reconhecimento específico entre o primeiro anticorpo não fluorescente e o antígeno de interesse; a presença deste primeiro anticorpo determina a do segundo, que é marcado e graças ao qual a presença ou ausência do antígeno pode ser determinada.
Apesar de ser uma técnica muito mais demorada do que a imunofluorescência direta (pois inclui mais uma etapa de incubação), essa técnica não envolve o desenho de um anticorpo fluorescente para cada antígeno estudado, o que resulta, em termos econômicos, mais viável.
Além disso, é uma técnica mais sensível em termos de amplificação do sinal, uma vez que mais de um anticorpo secundário pode se ligar à região constante do anticorpo primário, amplificando assim a intensidade do sinal fluorescente..
Formulários
Como pode ter sido observado anteriormente, a imunofluorescência é uma técnica extremamente versátil, que tem uma multiplicidade de utilizações no campo científico e clínico. Pode ser usado para responder a questões ecológicas, genéticas e fisiológicas relativas a muitos organismos.
Dentre as aplicações clínicas, é utilizado para o diagnóstico direto de algumas doenças dermatológicas, seja pela imunofluorescência direta ou indireta no tecido epitelial dos pacientes estudados..
As técnicas de imunofluorescência estão disponíveis em organismos unicelulares, como leveduras, para visualizar microtúbulos intranucleares e citoplasmáticos, actina e proteínas associadas, filamentos de 10 nm e outros constituintes do citoplasma, membrana e paredes celulares..
Referências
- Abcam, protocolo de imunocitoquímica e imunofluorescência. Obtido em abcam.com
- Greph, C. (2012). Corantes Fluorescentes. Obtido em leica-microsystems.com
- Miller, D. M., & Shakest, D. C. (1995). Microscopia de imunofluorescência. Dentro Métodos em Biologia Celular (Vol. 48, pp. 365-394). Academic Press, Inc.
- Odell, I. D., & Cook, D. (2013). Técnicas de imunofluorescência. Journal of Investigative Dermatology, 133, 1-4.
- Princle, B. J. R., Adams, A. E. M., Druain, D. G., & Brian, K. (1991). Métodos de imunofluorescência para leveduras. Dentro Métodos de Enzimologia (Vol. 194, pp. 565-602). Academic Press, Inc.
- Schaeffer, M., Orsi, E. V, & Widelock, D. (1964). Aplicações da imunofluorescência na Virologia em Saúde Pública. Avaliações bacteriológicas, 28(4), 402-408.
- Vrieling, E. G., & Anderson, D. M. (1996). Imunofluorescência na pesquisa de fitoplâncton: aplicações e potencial. J: Phycol., 32, 1-16.



Ainda sem comentários